|
北京延庆县初三上学期期末考试
化学试卷
2007.1
试卷说明:
本试卷分为第I卷、第II卷,共42个小题,共8页,满分80分。答题时间为100分钟。请使用蓝色或黑色钢笔或圆珠笔答题。
可能用到的相对原子质量:
H—1 C—12 N—14 O—16 Na—23 Mg—24 S—32 Cl—35.5 K—39 Ca—40 Fe—56 Zn—65 I—127
第Ⅰ卷 (选择题 30分)
注意:请将选择题答案填入第8页表格内
一、下列各题均有4个选项,其中只有1个是符合题意的(共30个小题,每小题1分,共30分)。
1.下列过程中,主要通过化学变化实现的是

2.通过对化学的学习,我们重新认识了早已熟悉的空气和水,知道了自然界中的水是
A.氧化物 B.混合物 C.纯净物 D.单质
3.生物细胞中含量最多的元素是
A.氢 B.碳 C.氮 D.氧
4.根据下列原子结构示意图判断,属于金属元素的是
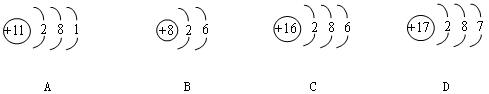
5.通过学习化学,我们知道了人的衣食住行都离不开化学。在生活中,下面四种做法有益于人体健康的是
A.健康人应该多吸纯氧 B.长期饮用硬水补钙
C.食用加碘食盐 D.吸烟提神
6.下列方法中能用于区别硬水和软水的是
A.观察颜色 B.溶解食盐 C.加入明矾 D.加肥皂水搅拌
7.下列方法不能用来区别氧气和二氧化碳两种气体的是
A.将气体分别通入水中 B.将气体分别通入到澄清的石灰水中
C.将气体分别通入到紫色石蕊试液中 D.将燃着的木条分别伸入到两种气体中
8.燃着的火柴梗竖直向上,火柴梗不易继续燃烧,其原因是
A.火柴梗温度不易达到着火点 B.火柴梗着火点高
C.火柴梗着火点低 D.火柴梗接触不到氧气
9.夏天从冰箱中拿出一瓶饮料,放在空气中,外壁会潮湿,这说明空气中含有
A.氧气 B.氮气 C.水蒸气 D.稀有气体
10.做铁丝在氧气里燃烧的实验时,预先在集气瓶里装少量水或细沙所起的主要作用是
A.防止瓶底炸裂 B.降低瓶内温度
C.增加氧气含量 D.吸收生成的物质
11.下列实验操作中,正确的是
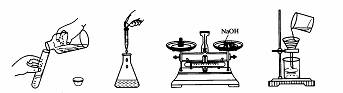
A B C D
12.为了用实验证明蜡烛燃烧的产物有水生成,最简单的做法是在蜡烛火焰上方
A.罩一个湿的烧杯 B.罩一个干而冷的烧杯
C.罩一个热的烧杯 D.罩一个内壁涂有澄清石灰水的烧杯
13.碳在氧气中充分燃烧的现象是
A.生成CO2 B.产生大量烟 C.发白光 D.火星四射
14.我国淡水资源非常缺乏,在生活中要注意节约用水,保护水资源。下列做法或想法正确的是
A.控制水中所有动植物的生长 B.可用过滤、蒸馏、吸附等方法净化水
C.废水只要无色透明就可以直接排放 D.大量开采地下水以满足社会对水的需求
15.“高钙牛奶”中的钙是指
A.单质 B.分子 C.原子 D.元素
16.为了迎接2008年奥运会,从2004年开始加大力度对北京市空气污染状况进行治理。这两年我市空气污染状况逐渐得到改善,每年空气污染指数在二级以上的天数越来越少,2006年,北京地区空气质量日报公布的首要污染物是
A.二氧化硫 B.二氧化氮 C.一氧化碳 D.可吸入颗粒物
17.相同数目的SO2分子和H2SO4分子中所含
A.原子的个数相同 B.硫元素的个数相同
C.硫原子的个数相同 D.硫元素的质量分数相同
18.亚硫酸钠(Na2SO3)是一种重要的化工原料,大量用于染料工业。亚硫酸钠中硫元素的化合价是
A.-2 B.+2 C.+4 D.+6
19.生活中的下列物质放入水中,能形成溶液的是
A.蔗糖 B.纯水冰块 C.豆油 D.面粉
20.下列关于分子、原子的叙述中,错误的是
A.分子、原子都在不断的运动 B.原子由分子直接构成
C.原子失去电子形成阳离子 D.原子是由原子核和核外电子构成的
21.为了探究水电解的微观过程,某同学做了一些下图所示的分子、原子的模型,若用“ ”表示氢原子,用“ ”表示氢原子,用“ ”表示氧原子,其中能保持氢气的化学性质的粒子是 ”表示氧原子,其中能保持氢气的化学性质的粒子是
A. B. B. C. C. D. D.
22.用氯化钠固体配制一定质量分数的氯化钠溶液,不需要用到的仪器是

A. B. C. D.
23.原子发生化学反应的根本原因是
A.原子都容易失去电子 B.原子都容易得到电子
C.原子的结构都不稳定 D.原子都有达到稳定结构的趋向
24.维生素C(化学式为C6H8O6)主要存在于蔬菜和水果中,它能促进人体生长发育,增强人体对疾病的抵抗力。2006年来科学家还发现维生素C有防癌作用。下列关于维生素C的说法中错误的是
A.维生素C的相对分子质量是176
B.维生素C是由C、H、O三种元素组成
C.维生素C中碳元素的质量分数为6%
D.维生素C中C、H、O三种原子的个数比为3∶4∶3
25.氧气分子和水分子中都含有氧原子,它们统称为氧元素。其原因是不管在氧气分子中,还是在水分子中,这些氧原子都具有相同的
A.核外电子数 B.核内质子数 C.核内中子数 D.相对原子质量
26.熟石灰可改良酸性土壤,但不能与铵态氮肥混合施用,其原因是两者混合会发生化学反应:Ca(OH)2 + 2NH4Cl →CaCl2 + 2H2O + 2 ↑,请判断 ↑,请判断 中物质的化学式 中物质的化学式
A.N2 B.NO C.NO2 D.NH3
27.下列化学方程式书写正确的是

28.现有20%的氯化钠溶液,根据“20%”这一数值,你可以知道该溶液
A.溶液质量为100g B.溶质质量为20g
C.水的质量为80g D.溶质∶溶剂∶溶液 (质量比)= 1∶4∶5
29.如右图所示,给饱和澄清石灰水加热。以下叙述不正确的是
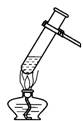
A.溶液由澄清变浑浊
B.氢氧化钙的溶解度随温度升高而增大
C.溶液仍为饱和溶液
D.溶液中溶质的质量分数减小
30.甲乙两种化合物都是由X、Y两种元素组成的,甲物质中含X元素50%,乙物质含Y元素为60%。已知甲物质的化学式为XY2,则乙物质的化学式为
A.XY3 B.X2Y C.XY4 D.X2Y3
第Ⅱ卷(非选择题 50分)
二、填空及简答题(共6个题,共26分)
31.(4分)我们在本学期里学过的一些物质如氧气、二氧化碳和水等,在实际生活中有着重要的用途。物质的用途是由其性质决定的。请填空:
(1)利用水具有溶解其他物质的性质,水可以作_________________;
(2)冬天烧煤取暖的原因之一是氧气具有_________________性质;
(3)因为二氧化碳具有____________________性质,所以它能_______________。
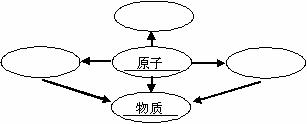
32.(6分)(1)构建知识网络是一种重要的学习方法。小莉同学对物质的组成和结构方面进行了归纳,如下图,请你帮她填写下图空白,要体现概念间的相互联系以及概念的辨析和应用。
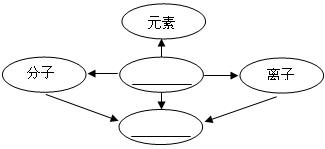
(2)在①N ②Mg2+ ③  ④2H ⑤Fe ⑥O2 六种化学符号中能表示分子的是(填序号,下同)__________;能表示离子的是__________;表示原子的是________________;表示三种意义的是______________。 ④2H ⑤Fe ⑥O2 六种化学符号中能表示分子的是(填序号,下同)__________;能表示离子的是__________;表示原子的是________________;表示三种意义的是______________。
33.(5分)将一只小白鼠放在内壁涂有澄清石灰水的集气瓶中,并密封(如右图),发现小白鼠仍然活一段时间,且瓶壁逐渐变模糊。请回答下列问题:
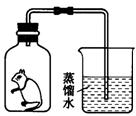
(1)小白鼠能存活一段时间的原因是__________________。
(2)瓶壁变模糊的原因是:_______________(写化学方程式)。
(3)烧杯中导管内的液面高度的变化是________________。
(4)最后瓶内剩余气体的主要成分是__________________。
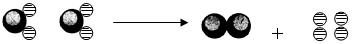
34.(4分)下图中“ ”和“ ”和“ ”分别表示不同质子数的原子在化学变化前后的微观模拟示意图。 ”分别表示不同质子数的原子在化学变化前后的微观模拟示意图。
+ | | 
图中能够说明的问题有:(要求答出3个不同方面的问题)
(1)__________________________________________________________
(2)__________________________________________________________
(3)__________________________________________________________
请你根据上述提示和所学知识,画出水通电分解的微观模拟示意图:
35.(3分)20℃时,分别将等质量的甲、乙两种固体物质加入到盛有10g水的两支试管中,充分溶解后,可观察到如下图一所示的现象。20℃时_______(“填“甲”或“乙”)物质的溶液一定是饱和溶液。图二表示的是甲、乙两种物质在水中的溶解度曲线。要使甲试管中的剩余固体继续溶解,可采用的方法有_____________、___________。
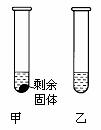 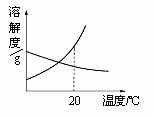
图一: 图二:
36.(4分)在一定条件下,向一密闭容器内加入A、B、C、D四种物质各20g,充分反应后测定其质量,得到数据如下:
|
物质 |
A |
B |
C |
D |
|
反应前质量(g) |
20 |
20 |
20 |
20 |
|
反应后质量(g) |
20 |
30 |
未知 |
14 |
请回答下列问题:
(1)容器内发生的反应的基本类型是___________________。
(2)反应后容器C的质量为___________________。
(3)容器内发生的反应可表示为___________________________(用字母表示)。
三、实验及探究题(共4个小题,共18分)
37.(2分)酒精灯是中学化学实验中最常见的加热仪器,请回答下列有关问题:
(1)熄灭酒精灯时用灯帽盖灭,这种灭火方法的主要原理是__________________。
(2)化学实验中,如果不慎碰倒酒精灯,洒出的酒精在桌子上燃烧起来,你应采用的灭火方法是____________________________________________。
38.(10分)小红同学用加热高锰酸钾的方法制取氧气。
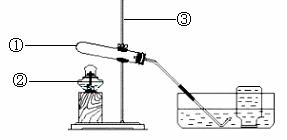
实验装置示意图如图所示。
回答下列问题:
(1)写出下列序号仪器的名称:
①_______________,②_________________, ③__________________。
(2)实验室用高锰酸钾制取氧气反应的化学方程式为:
。
(3)实验室制取氧气的主要操作步骤有①从水槽中取出导管 ②检验装置的气密性
③停止加热 ④收集气体 ⑤加热 ⑥加入药品,请写出正确的操作顺序 (填序号):____________________________________________________。
(4)小红做该实验出现了下列异常现象,请你分析其原因:
|
现象 |
原因 |
|
水槽中水呈紫红色 |
|
|
水被倒吸沿导管进入试管中 |
|
(5)检验装置气密性的操作如下(如图所示):
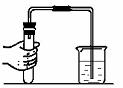
先将导管伸入液面下,用手紧握试管,观察到 ________,
松开手后,导管口内有液面上升。
(6)小刚同学认为用过氧化氢分解的方法制取氧气更为方便,其反应的化学方程式为: ___________________________________________________
该方法用到的二氧化锰的作用是_______________________________。
39.(2分)溶液在生产和科研中具有广泛的用途。在农业上,为了选种子,需要配制15%的食盐溶液。现有30kg食盐固体,可配制15%的食盐溶液__________kg。配制食盐溶液的一般步骤为①计算,②__________________________________,③溶解。
40.(4分) 物质发生化学反应会有新物质生成,几乎同时还伴随着能量的变化——放热或吸热。某同学在某一食品包装袋中发现一个装有白色颗粒状固体A的小纸袋,如右图。该同学随手将小纸袋拿出来放在空气中,经过一段时间后,发现纸袋内的白色颗粒粘在一起成为块状固体B。已知生石灰吸收水分后变成熟石灰,请你与该同学一起对块状固体B进行探究。
(1)猜想一:块状固体B中除了氧化钙外,还可能有______________________________(写化学式)。
(2)猜想二:块状固体B溶于水可能有放热现象。
请设计实验方案验证你的这一猜想(至少写出两种方案,写出三种方案奖励1分):
①____________________________________________________________________;
②____________________________________________________________________;
③________________________________________________________________。
四、计算题(共2个小题,共6分)
41.(3分) 实验室用大理石和稀盐酸制取二氧化碳,现有含杂质为5%的大理石100g,使之与稀盐酸反应(杂质不参加反应),问最多能制取二氧化碳多少克?(最后结果保留一位小数)
42.(3分)我国规定用碘盐中碘元素的含量为每千克食盐含碘0.02~0.04g。生产中通常加入碘元素的稳定化合物碘酸钾(KIO3)来达到这一生产标准。现有10t食盐,应加入碘酸钾的质量范围是多少?(计算结果保留整数)
2006年北京延庆县初三上学期期末考试
化学试卷
参考答案
一、选择题(共30分,每小题1分)
|
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
答案 |
A |
B |
D |
A |
C |
D |
A |
A |
C |
A |
|
题号 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
答案 |
B |
B |
C |
B |
D |
D |
C |
C |
A |
B |
|
题号 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
|
答案 |
A |
B |
D |
C |
B |
D |
C |
D |
B |
A |
二、填空题(共26分,每空1~2分)
31. (4分)(1)溶剂
(2)支持燃烧(或氧化性)
(3)不燃烧和不支持燃烧 灭火 (其他合理答案给分)
32.(6分)(1)
(2)⑥ ② ①④⑤ ⑤
33.(5分)(1)集气瓶中有氧气(或空气)
(2)CO2 + Ca(OH)2 → CaCO3↓ + H2O ……(2分)
(3)上升(或升高)
(4)N2(或氮气)
34.(4分)
(1)该反应属于分解反应 (反应的基本类型)
(2)化学变化前后原子的种类、数目不变 (微观方面)
(3)化学变化前后元素种类没变 (宏观方面)
(4)化学反应的实质是原子的重新组合或化学反应中分子可以再分,原子不能再分(反应实质方面) (其他合理答案给分)
35.(3分)甲 加水 降温
36.(4分)(1)化合反应
(2)16g
(3)C + D → B(2分)
三、实验题(共18分,每空1~2分)
37.(2分)(1)隔绝空气 (2)用湿抹布盖灭
38.(10分)
(1)试管 酒精灯 铁架台
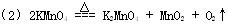
(3)②⑥⑤④①③
(4)试管口内没有放棉花,高锰酸钾受热分解速度快,少量高锰酸钾颗粒随气体进入水槽里,溶解在水中,使水槽中水呈紫红色。
实验结束时,先停止加热,后将导管移出水槽。在大气压强的作用下,水沿导管被倒吸进入试管中。(答出强调的重点内容即给分)
(5)烧杯内导管口有气泡时
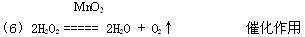
39.(2分) 200 称量固体和量取液体 (两方面都答全才给分)
40.(4分)
(1)Ca(OH)2 CaCO3 (2分) (一个化学式1分)
(2) ①取少量块状固体B放入烧杯中,加入少量水,用手触摸烧杯外壁。
②取适量块状固体B放入烧杯中,加入少量水,立即用温度计测定溶液温度的变化
③在试管中加入块状固体B,加入少量水,立即塞上带导管的单孔橡皮塞,同时将导管另一端放入盛水的水槽中,观察导管口是否有气泡放出。
④在试管中加入块状固体B,加入少量水,立即在试管口套上一只瘪气球,观察气球体积变化(本题要求写出实验操作过程)(其他合理答案给分)
四、计算题(共6分)
41.(3分)解:设能制取CO2的质量为x
CaCO3 + 2HCl == CaCl2 + H2O + CO2 ↑……(1分)
100 44
100g×95% x
= …………………(1分)
x = 41.8g …………………(1分)
答:略。
42.(3分)
解:每千克食盐含碘0.02~0.04g。则10t食盐应含碘200~400g ……………(1分)
KIO3的相对分子质量=214
若含200g碘元素,需要KIO3的质量为:
200g÷ =337g ………………(1分)
若含400g碘元素,需要KIO3的质量为:337g×2=674g
所以应加入碘酸钾的质量范围为337g~674g ………………(1分)
答:略。
|