一、 选择题(每小题有一个或两个正确选项符合题意)
1、 导致下列现象的主要原因与排放二氧化硫有关的是
A、温室效应 B、光化学烟雾 C、臭氧空洞 D、酸雨
2、 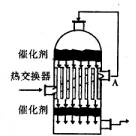 在硫酸工业生产中,为了有利于二氧化硫的转化,且能够充分利用热能,采用了中间有热交换器的接触室(右图),按此密闭体系中气体的流向,则在A处流出的气体有
在硫酸工业生产中,为了有利于二氧化硫的转化,且能够充分利用热能,采用了中间有热交换器的接触室(右图),按此密闭体系中气体的流向,则在A处流出的气体有
A、二氧化硫 B、三氧化硫和氧气
C、二氧化硫和氧气 D、二氧化硫和三氧化硫
3、 50 m L 18 mol·L—1的硫酸中加入足量的铜片并加热。充分反应后,被还原的硫酸的物质的量为
A、等于0.9mol B、大于 0.45mol,小于0.9mol
C、等于0.45mol D、小于0.45mol
4、 锌贝白是一种白色颜料,其主要成分是难溶于水的锌盐和钡盐,它们是
A、ZnCO3和BaCl2 B、BaSO4和ZnS
C、BaCO3和ZnCl2 D、ZnCO3和Ba(NO3)2
5、 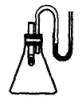 如图所示,小试管内盛有约3 mL饱和硫酸铜溶液,与锥形瓶连通的U形管内盛有少量水(为了便于观察,已染成红色)。沿小试管的内壁小心地慢慢注入约3mL浓硫酸,静置片刻,不可能观察到的现象有
如图所示,小试管内盛有约3 mL饱和硫酸铜溶液,与锥形瓶连通的U形管内盛有少量水(为了便于观察,已染成红色)。沿小试管的内壁小心地慢慢注入约3mL浓硫酸,静置片刻,不可能观察到的现象有
A、小试管内液体分成两层上层蓝色,下层无色
B、U形管内左边液面下降,右面液面升高
C、有少量白色固体析出 D、有少量蓝色晶体析出
6、 在100g物质的量浓度为18 mol·L—1,密度为a g/cm3的浓硫酸中加入一定量的水稀释成9mol/L的硫酸溶液。则加入的水的体积是
A、<100mL B、=100mL C、>100mL D、=100/a mL
7、 浓硫酸和锌反应,反应的锌和硫酸的质量比为26:49,则还原产物是
A、二氧化硫 B、硫 C、硫化氢 D、硫酸锌
8、 用浓硫酸吸收三氧化硫可以得到H2SO4·SO3,若用1 kg 98%的浓硫酸充分吸收三氧化硫后,再进行稀释,可得到98%的硫酸质量是
A、1.98kg B、2.00kg C、2.22kg D、2.42kg
二、填空题
9、 如图所示的装置,可用来检验浓硫酸与木碳粉在加热的条件下反应产物产生的所有气体产物,填写下列空白:
(1)如果将装置中的①②③三部分仪器的连接顺序改为②①③,则可检验出的物质是_________,不能检验出的物质是________________。
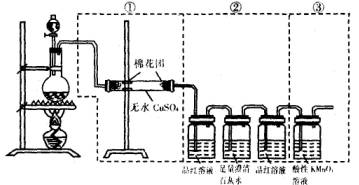 (2)如果将装置中的①②③三部分仪器的连接顺序改为①③②,则可检验出的物质
(2)如果将装置中的①②③三部分仪器的连接顺序改为①③②,则可检验出的物质 是_________,不能检验出的物质是_______。
是_________,不能检验出的物质是_______。
(3)如果将装置中的①②③三部分仪器的连接顺序改为②③①,则可检验出的物质是_________,不能检验出的物质是_______。
10、  比较过量的①锌与稀硫酸②过量的铜与浓硫酸两个反应,请从多方面考虑,简要描述一下两个反应的不同之处(要求:将每一方面的区别列举出来,并写出差异内容,可不填满,也可增加)
比较过量的①锌与稀硫酸②过量的铜与浓硫酸两个反应,请从多方面考虑,简要描述一下两个反应的不同之处(要求:将每一方面的区别列举出来,并写出差异内容,可不填满,也可增加)
(1)____________________________(2)____________________________
(3)____________________________(4)____________________________
(5)______________ 。
11、 
 甲、乙、丙三位同
甲、乙、丙三位同
学设计基本相同的试验检验硫酸根离子,甲的试验如上,甲由此得出了A溶液含硫酸根离子。乙认为甲的实验欠严谨。他的实验如下,并认为这样才能证明B溶液中含硫酸根离子。
丙则认为乙的实验也不严谨,他设计一种用氯化钡溶液和盐酸检验C中是否含有硫酸根离子的实验方案。经研究在中学化学知识范围内丙的设计是正确的,请回答:
(1)试样A中除含有硫酸根离子外还有可能含离子(填一种常见离子)
(2)试样B中除含有硫酸根离子外还有可能含离子(填一种常见离子)
(3)丙设计的实验步骤和实验方案(括号内填步骤,方框填现象)
三、计算
12、 取某城市煤样品4.8g,使之完全燃烧,将生成的二氧化硫通入足量的氯水溶液,过滤后,用0.1 mol·L—1的硫酸钠溶液滴定滤液,当滴入10.0mL硫酸钠溶液时能恰好将溶液中的钡离子完全沉淀出来。
(1)求该城市燃煤的含硫量;
(2)假设该城市每天烧煤8×104kg,其中有80%的硫转化为二氧化硫进入空气,这些二氧化硫中的20%未能扩散而被氧化后随着约8×109L雨水降落到城市地面上,则这次酸雨的PH值为多少?