一、选择题(第小题只有一个选项符合题意)
1.我国科学家首次合成了一种新核素镅(95Am)-235,以下有关这种新核素与铀( 92U)-235的比较中叙述正确的是( )
(A)具有相同的核电荷数 (B)原子核内具有相同的中子数
(C)原子核外的电子总数相同 (D)具有相同的质量数
2.“绿色化学”是当今社会提出的一个新概念。在“绿色化学工艺”中,理想状态是反应物中原子全部转化为欲制得的产物,即原子利用率为100%。在用CH3CH=CH2合成CH2=C(CH 3)COOCH3的过程中,欲使原子利用率达到最高,还需要其他的反应物有( )
(A)CO和CH3OH (B)CO2和H2O
(C)H2和CO2 (D)CH3OH和H2
3.以上各选项的叙述中都包含两个数值,前一数值大于后一数值的是( )
(A)单质碘中的分子间作用力和干冰中的分子间作用力
(B)NaCl晶体中与一个Cl-紧邻的Na+数和CsCl晶体中与一个Cl-紧邻的Cs+数
(C)晶体硅中Si—Si键的键能和金刚石中C—C键的键能
(D)氨分子中N—H键的解和甲烷分子中C—H键的键角
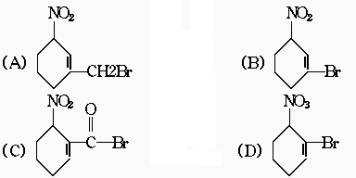
4.已知羧酸、碳酸、酚的酸性由强至弱,并知以下含溴化合物中的溴原了在适当的条件下都能被羟基取代。所得产物跟NaHCO3溶液发生反应的是( )
5.在标准状况下,ag气体A与bg气体B的分子数相同,与此有关的以下说法中不正确的是( )
(A)A与B的摩尔质量之比为a:b
(B)相同状况下,同体积的A与B的质量之比为a:b
(C)质量相同的A与B的分子数之比为b:a
(D)同温同压下,A与B的密度之比为b:a
二、选择题(每小题有1~2个选项符合题意)
6.含有Cr2O2-7的工业酸性废水会对环境造成铬污染,排放前要进行如下处理: ①先将Cr2O2-7还原成Cr3+;②加入适量的固体NaOH,以铁为电极电解,同时持续地向溶液中鼓入空气,以使溶液的pH值不断升高,即令溶液由酸性转为碱性,Cr3+则以氢氧化物沉淀被除去.
引起溶液的pH值不断升高的原因是 ( )
(A)作为阳极的铁不断溶解
(B)因电解过程消耗水而使溶液的体积不断减小
(C)电解时H+在阴极被还原
(D)Cr2O2-7转化为Cr3+时消耗了H+
7.Na3N是离子化合物,它能与水反应生成氨气。以下关于Na3N的说法中正确的是 ( )
(A)Na3N与盐酸反应时可生成两种盐
(B)在Na3N与水的反应中Na3N是还原剂
(C)在Na3N分子中Na+的半径比N3-的半径小
(D)Na+与N3-的电子层结构都与氩原子的结构相同
8.下列说法正确的是( )
(A)标准状况下,NA个水分子所占体积约为22.4L
(B)常温常下,22.4L N2所含的分子数大于NA个
(C)在1 mol Fe3O4中加入足量盐酸,反应中电子转移的总数为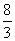 NA
NA
(D)在标准状况下,Cl2与H2的混合气22.4L,光照后原子数为2NA个
9.在-50℃时液氨中存在着下列平衡:2NH3(液) NH+4+NH-2,两种离子的平衡浓度均为1.0×10-15mol·L-1。以下有关-50℃时离子积的叙述中正确的是( )
NH+4+NH-2,两种离子的平衡浓度均为1.0×10-15mol·L-1。以下有关-50℃时离子积的叙述中正确的是( )
(A)离子积为1.0×10-15
(B)离子积为1.0×10-30
(C)向液氨中加入氨基钠(NaNH2),液氨的离子积不变
(D)向液氨中加入NH4Cl,[NH+4]增大,离子积的数值也随之增大
10.现有两种烯烃CH2=CH-CH3和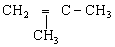 将它们混合在一起,在一定条件下可发生加聚反应,反应后的产物可能有
将它们混合在一起,在一定条件下可发生加聚反应,反应后的产物可能有
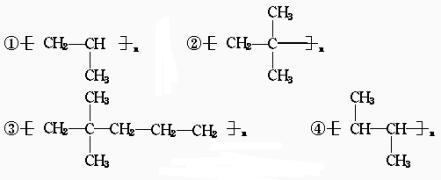

其中正确的是( )
(A)①②⑥
(B)①②③⑤
(C)①②③⑥
(C)①②⑤
11.向Fell3 - AlCl3混合溶液中先加入过量的NaI溶液,再加入足量的Na2S溶液,可生成多种沉淀物,这些沉淀物是( )
(A)Al2S3和I2
(B)Fe(OH)3和Al(OH)3
(C)Fe2S3和I2
(D)FeS、S和Al(OH)3
12.下列反应的离子方程式中正确的是( )
(A)向饱和Na2CO3的溶液中不断通入CO2:
CO2+2Na++CO2-3+H2O=2NaHCO3
(B)用饱和FeCl3溶液制取Fe(OH)3胶体:
Fe3++3H2O Fe(OH)3↓+H+
Fe(OH)3↓+H+
(C)向Ba(OH)2溶液中逐渐加入NH4HSO4溶液,使Ba2+恰好完全沉淀:
Ba2++2OH-+NH+4+H++SO2-4=BaSO4↓+NH3·H2O+H2O
(D)用惰性电极电解MgCl2溶液:
Mg2++2Cl-  Mg+Cl2↓
Mg+Cl2↓
13.在许多化合物中S可以取代O,取代后的物质仍跟原化合物具有相似的性质,下面是两种有机磷农药的结构:
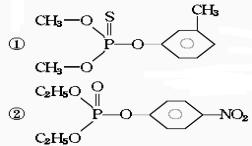
这两种农药在使用过程中不能与下列哪种物质混合使用( )
(A)KCl (B)Ca(OH)2 (C)CO(NH2)2 (D)Na2SO4
14.将铝粉与下列氮的气态氧化物混合起来,加热至高温,都可生成氮气和氧化铝。若反应后气体的体积是反应前气体体积的一半(气体的体积都是在相同状况下测定的),则参加反应的氮的氧化物可能是( )
(A)NO (B)N2O3 (C)NO2 (D)N2O5
15.在一定条件下,阿斯匹林(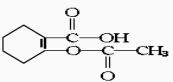 )可能发生的反应有:( )
)可能发生的反应有:( )
①加成 ②水解 ③消去 ④酯化 ⑤银镜反应 ⑥中和
(A)①②④⑥ (B)②③④⑥
(C)②④ (D)④⑥
16.常温下,已知0.1 mol/L的某一元碱MOH溶液中[H+]/[OH-]=10-12,0.1m ol/L的某一元酸HA溶液的pH>1,将两溶液等体积混和后,各离子浓度由大到小的顺序正确的是( )
(A)[OH-]>[H+]>[A-]>[M+]
(B)[M+]>[A-]>[H+]>[OH-]
(C)[M+]>[A-]>[OH-]>[H+]
(D)[A-]>[M+]>[H+]>[OH-]
17.某酸式盐NaHY在水溶液中HY-的电离度小于HY-的水解程度。与此有关的以下叙述中正确的是( )
(A)H2Y的电离方程式为H2Y+H2O HY-+H3O+
HY-+H3O+
(B)在NaHY的水溶液中各离子浓度间的关系为[Na+]>[Y2-]>[HY-]>[H+]
(C)在NaHY的水溶液中各离子浓度间的关系为[Na+]>[HY-]>[OH-]>[H+]
(D)HY-的水解方程式为HY-+H2O H3O++Y2-
H3O++Y2-
三、选择题(每小题只有一个选项符合题意)
18.有X、Y、Z三种盐。已知(1)25℃时,X的饱和溶液中X的质量分数为15%;(2)25℃时,向100g质量分数为10%的Y的溶液中加入5gY的无水盐,可恰好达到饱和;(3)25℃时,从一定量的Z溶液中蒸发掉5.75g水,再恢复至25℃,或保持在25℃时向其中加入6.3gZ的结晶水合物( Z·9H2O,其式量为240),都可恰好形成饱和溶液。25℃,X、Y、Z(均指不含结晶水的盐) 的溶液解度由大到小的顺序为( )
(A)X>Y>Z (B)Z>Y>Z
(C)Z>X>Y (D)Y>Z>X
19.将KCl和CrCl3两种固体混合、熔烧,可制得化合物X。将1.892gX中的铬元素氧化为Cr2O2-7,则Cr2O2-7可从过量的KI溶液中氧化出2.667g单质碘,反应的离子方程式为Cr2O2-7+6I-+14H+=2Cr3++3I2+7H2O。现取溶有1. 82 9gX溶液,向其中加入过量的硝酸银溶液,可得4.52g白色沉淀。表示X组成的化学式为( )
(A)K2Cr2Cl7 (B)K3Cr=Cl5
(C)K3Cr2Cl9 (D)K3Cr2Cl4
20.某结晶水合物的化学式为R·nH2O,其式量为M。25℃时,将ag该晶体溶于bg水中可形成VmL饱和溶液。下列关系中正确的是( )
(A)饱和溶液的物质的量浓度为c=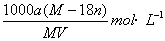
(B)饱和溶液中溶质的质量分数为W=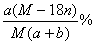
(C)25℃时R的溶解度为S=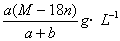
(D)饱和溶液的密度为ρ=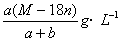
21.有一铁的氧化物样品,用140mL5mol·L-1盐酸可恰好使其完全溶解。所得溶液可吸收标准状况下0.56L氯气,使其中的Fe2+全部转化为Fe3+。该样品可能的化学式为( )
(A)Fe4O5 (B)Fe5O7
(C)Fe2O3 (D)Fe3O4
22.乙烯酮(CH2=C=O)在一定条件下能与含活泼氢的化合物发生加成反应,反应可表示成
CH2=C=O+HA→CH3—C—A。乙烯酮在一定条件下与下列各试剂发生加成反应时所得产物不正
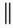
O
确的是( )
(A)与HCl加成时得CH3COCl
(B)与H2O加成时得CH3COOH
(C)与CH3OH加成时得CH3COCH2OH
(D)与CH3COOH加成时得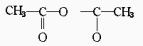
23.在一定条件下,萘可被浓硫酸、浓硝酸的混合酸硝化,生成二硝基化合物——1,5-二硝基萘 的混合物。后者可溶于质量分数大于98%的硫酸中,而前者却不能。利用这一性质可将这两种异构体分离开来。
的混合物。后者可溶于质量分数大于98%的硫酸中,而前者却不能。利用这一性质可将这两种异构体分离开来。
将这两种硝化产物加入适量的98%硫酸中,充分搅拌,用耐酸漏斗过滤 。要从滤液中得到固体1,8-二硝基萘,应采用的方法是( )
(A)蒸发浓缩晶体
(B)向滤液中加水后过滤
(C)用Na2CO3溶液处理滤液
(D)将滤液缓缓加入水中
24.金属钠能溶解在液氨中形成蓝色的溶液,有人认为蓝色是生成了电子的氨合物e(NH3)-n所致,此反应可写作Na+nNH3=Na++e(NH3)-n。小心蒸发蓝色溶液,可发生下列反应:Na+2NH3=NaNH2+H2,NaNH2是白色的固体物质。以下叙述中不正确的是( )
(A)NaNH2在液氨中不能电离
(B)钠溶于液氨形成的溶液是强还原剂
(C)蒸发蓝色溶液时蓝色会逐渐褪去
(D)蒸发过程中液氨被氧化为H2
25.1.92g铜投入一定量的浓HNO3中,铜完全溶解,生成的气体颜色越来越浅,共收集到标准状况下672mL气体。将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2, 恰好使气体完全溶于水中,则通入O2的体积是( )
(A)504mL (B)168mL (C)336mL (D)224mL
四、非选择题
26.下图转化过程中A、B、C为中学化学常见元素的化合物,甲、乙、丙为单质。
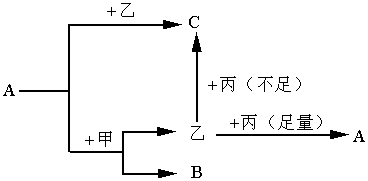
(1)若甲作还原剂,C的化学式为 ;A与甲的反应方程式为 。
(2)若甲作氧化剂,且都在溶液中进行的反应,则C的化学式为 。当A 与甲的物质的量之比为1∶1,则A与甲发生反应的离子方程式为 。
27.实验室里用下图示出的装置制取溴化亚铁。其中,A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈管,e是两只耐高温的瓷夹,其中共盛有56g细铁粉。实验开始 时先将铁粉加热至600~700℃,然后将干燥、纯净的CO2气流通入D中,E管中的物质开始反应,不断地将d中的液溴滴入100~120℃的D中,经过几小时的连续反应后在不锈钢管一端 沉积有黄绿色鳞片状溴化亚铁80g。
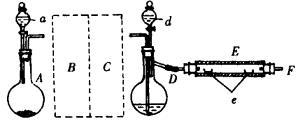
(1)如何检查D装置的气密性?
(2)若导入的CO2不干燥,会在E中发生副反应,其化学方程式为 。
(3)在A中盛有CaCO3,a中盛有6mol·L-1盐酸。为使A中产生的CO2在进入D之前既干燥又纯净,B、C处应设置何种仪器?各仪器中应盛有何种试剂?
(4)实验时,D和E的橡胶塞为什么最好用铝箔包住?
(5)反应过程中要不断地通入CO2,其主要作用是:① ② 。
(6)E中进行的反应是:2Fe+3Br2=2FeBr3,2FeBr3=2FeBr2+Br2↑。此实验中溴化亚铁的产率为 。
(7)为防止污染空气,实验时应在F处连接盛有 的尾气吸收装置。
28.A、B是两种盐,均为无色晶体。A的焰色反应(透过蓝色钴玻璃)为紫色,A的水溶液的pH >7。下面是对A、B两种盐进行实验所做的记录,其中的H、G均为不溶于酸的白色沉淀。
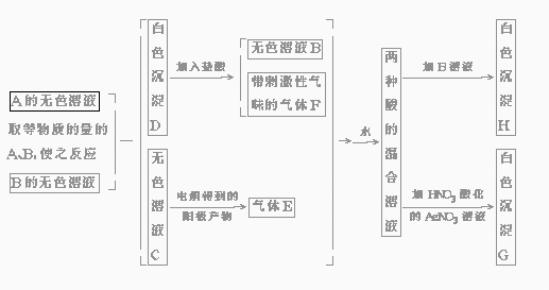
(1)写出两种盐的化学式:A. ,B. 。
(2)等物质的量A、B反应的离子方程式为 。
(3)将E、F混合起来,通入水中发生的反应的化学方程式为 。
(4)电解C的无色溶液时阴阳两极所得气体的体积比的理论值应为1∶1,而实际收集到的气体的体积比却大于1∶1,这是为什么?
29.实验室临时需要用NaOH溶液和CO2来制取纯Na2CO3溶液。已知CO2气体在通入NaOH溶液时极易因其过量而生成NaHCO3,且无明显现象。
实验时可供选择的试剂有:①未知浓度的NaOH溶液;②37%盐酸;③40%的硫酸;④14%盐酸;⑤大理石;⑥K2CO3固体;⑦Cu2(OH2)CO3粉末。
实验室现有以下仪器:铁架台、启普发生器、量筒、烧杯、乳胶管、玻璃导管、分液漏斗。
下表所列为有关物质在常温时的溶解度(g/100g水)
|
Na2CO3 |
NaHCO3 |
NaCl |
Na2SO4 |
NaHSO4 |
NaOH |
|
|
15.9 |
8.40 |
35.8 |
35.5 |
20.0 |
40.0 |
|
(1)本实验应选用的仪器,除启普发生器、乳胶管、玻璃导管外,还应有 。
(2)为保证制得的Na2CO3溶液尽量纯,应选用的药品,除①外,还应需要 。
(3)简要叙述实验步骤,直到制得纯Na2CO3溶液(仪器安装不必叙述):
①量取两份相同体积的NaOH溶液;
② ;
③ ;
④ ;
(4)根据给出的溶解度,若保证在配制过程中不析出晶体,所用的NaOH溶液中含NaOH的质量分数的最大值是多少(写出计算步骤和必要的文字说明)?
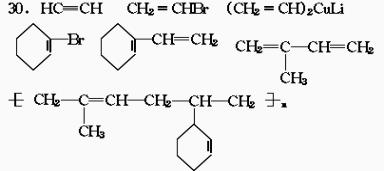
30.在金属锂和CuI存在的条件下,卤代烃之间可发生反应,生成一种烃。如
C4H9Cl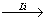 C4H9Li
C4H9Li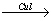 (C4H9)2CuLi
(C4H9)2CuLi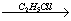 C4H9-C2H5
C4H9-C2H5
试将下列各步变化中各有机物的结构简式填入空白处:
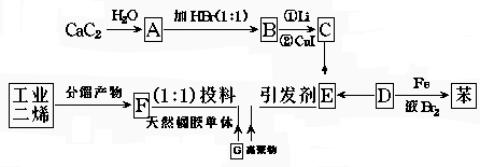
A. ,B. ,C. ,D. ,E. ,F. G. 。
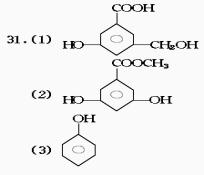
31.A、B、C、D均为含苯环的有机物,且式量B>A>C。已知有机物A既能和氢氧化钠溶液反应,又能和碳酸氢钠溶液反应,反应关系如下:
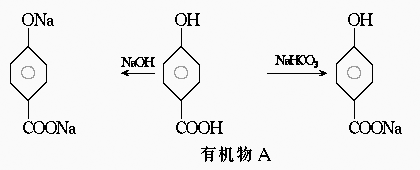
(1)在有机物B在浓硫酸存在的条件下,相互作用生成一种环状酯,结构如下所示,则有机物B的结合简式为 。
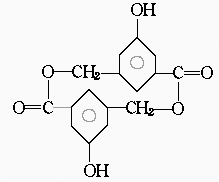
(2)D和B互为异构体,且知其苯环上的一氯代物只有两种,D不与NaHCO3反应,能与Na和Na OH反应,等质量的D消耗的Na、NaOH的物质的之比为2∶3,则D的结构简式为 。
(3)1 mol的A、C完全燃烧,消耗氧气的质量相等,且1 mol C能和 1 mol Na完全反应,则C 的结构简式为 。
32.已知在酸性条件下有如下关系:①KBrO3能把KI氧化成I2或KIO3,KBrO3本身被还原为Br2;②Br2能氧化I-为I2;③KIO3能氧化I-为I2;④KIO3能氧化Br-为Br2。在③④反应中KIO3被还原为I2。试回答:
(1)KBrO3、KIO3、Br2、I2氧化性由弱到强的顺序 。
(2)现取6 mL 0.4 mol·L-1KBrO3溶液和10 mL 0.4 mol·L-1KI溶液在稀H2SO4中混合,生成的产物是什么?物质的量之比为多少?
33.取0.45molNaOH、0.35molNa2 CO3和0.20molNaHCO3溶解于水,向该溶液中逐滴加入盐酸,反应明显地分为三个阶段走进。若加入HCl为nmol,所得混合溶液中NaCl、Na2CO3、NaHCO3分别为xmol和zmol,试分别计算n值增大的过程中,不同反应阶段的n值范围和所对应的x、y、z的值,并将结果填入下表:
|
加入的HCln(mol) |
溶液中NaClx(mol) |
溶液中的Na2CO3y(mol) |
溶液中的NaHCO3z(mol) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
参考答案:
1.D 2.B 3.A 4.C 5.D 6.CD 7.AC 8.AD 9.BC 10.D 11.D 12.AC 13.AC 14.AC 15.A 16.B 17.AC 18.C 19.C 20.C 21.B 22.C 23.D 24.D 25.C
26.(1)C的化学式为CO,A与甲的反应方程式为CO2+2Mg 2MgO+C
2MgO+C
(2)FeBr3,2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
27.(1)关闭d的活塞,夹紧C、D间的胶管,将F的出口导管插入水中,用手捂住D,微热,若F 的导管处有气泡冒出,松开手后水又回升到F的导管中,则证明D的气密性良好(即不漏气)
(2)3Fe+4H2O Fe3O4+4H2↑
Fe3O4+4H2↑
(3)B处应设置盛有NaHCO3饱和溶液的洗气瓶,C处应设置盛有浓H2SO4的洗气瓶
(4)因Br2会腐蚀橡胶塞
(5)①将容器中的空气赶净,②将Br2蒸气带入反应器D中
(5)37.04% (6)NaOH溶液
28.(1)K2SO3 BaCl2
(2)Ba2++SO2-3=BaSO3↓
(3)SO2+Cl2+2H2O=H2SO4+2HCl
(4)电解KCl溶液时阳极的产物为Cl2,阴极的产物为H2,因Cl2在水中及碱性溶液中的溶解性比H2大,故实际收集到的H2与Cl2的体积比大于1∶1
29.(1)烧杯,量筒
(2)④,⑤
(3)根据题目中第一步实验步骤,量取两份相同体积的NaOH溶液可知,一份NaOH溶液中通入过量的CO2气体,产生NaHCO3溶液,将等物质的量的NaOH的溶液和等物质的量NaHCO3 反应可制得纯Na2CO3。所以第二步:制取CO2,向其中一份NaOH溶液中,通入过量的CO2气。第三步:将两份溶液混合摇匀。
(4)解析:NaOH+CO2=NaHCO3
40 84
x 8.4g
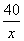 =
=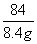 ,x=4.0g,
,x=4.0g,
CO=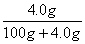 ×100%=3.85%,
×100%=3.85%,
为保证配制过程中不析出NaHCO3晶体,NaOH溶液的质量分数应不大于3.85%。
32.(1)I2<Br2<KIO3<KBrO3
(2)KBrO3的物质的量为0.4 mol·L-1×6 mL×10-3L·mL-1=2.4×10-3mol;KI的物质的量为0.4 mol·L-1×10ml×10-3L·mL-1=4× 10-3mol,若KBrO3完全被还原为Br2,所得电子数为2.4×10-3mol×5=12 ×10-3mol。若KI完全被氧化为I2,可失的电子数为4×10-3mol×1=4×10-3mol,若KI完全被氧化为KIO3,可失的电子数为4×10-3×6=24×10 -3mol。由以上数据可知,KBrO3 Br2,KI
Br2,KI I2+KIO3,写出总反应式, 各物质的计量数之比等于其物质的量之比:
I2+KIO3,写出总反应式, 各物质的计量数之比等于其物质的量之比:
6BrO3-+10I-+12H+=3Br2+3I2+4IO3-+6H2O,故所得产物为Br2、I2 、IO3-、H2O,物质的量之比为3∶3∶4∶6。
33.将题给数量的三种物质溶于水后,0.20molNaHCO3与0.45molNaOH反应新生成了0.20mol Na2 CO3(加上原0.35molNa2 CO3,共0.55mol),剩余了0.25molNaOH。加入盐酸后,HCl先与NaOH反应,再与Na2CO3反应生成NaHCO3,最后与NaHCO3反应。随n值的增大,不同阶段的n值范围与所对应的x、y、z值见下表:
|
0~0.25 |
N |
0.55 |
0 |
|
0.25~0.80 |
N |
0.8-n |
n-0.25 |
|
0.8~1.35 |
n |
0 |
1.35-n |