| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
第Ⅱ卷(非选择题,共60分)
二、实验题(本题包括1小题,共10分) 21.(10分)某爱好小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。 SHAPE \* MERGEFORMAT
 
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是________________。 (2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸,c中反应的化学方程式是 __________________________________。再由a向c中加2 mL蒸馏水,c中的实验现象是_________________________。 (3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是_______,理由是____________________________。
| 方案
| 反应物
| 甲
| Cu、浓HNO3
| 乙
| Cu、稀HNO3
| 丙
| Cu、O2、稀HNO3 |
(4)该小组还用上述装置进行实验证实氧化性KMnO4>Cl2>Br2,操作步骤为____________________________________ _ ,
实验现象为____________________________________________;但此实验的不足之处是__________________________ _。
三、推断题(本题包括1小题,共10分)
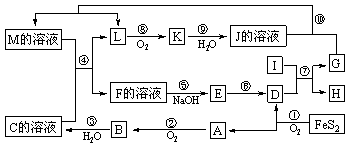
22.(10分)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第______周期第______族。
(2)在反应 = 7 \* GB3 ⑦中氧化剂与还原剂的物质的量之比为________。
(3)在反应 = 2 \* GB3 ②、 = 3 \* GB3 ③、 = 6 \* GB3 ⑥、 = 9 \* GB3 ⑨中,既属于化合反应又能属于非氧化还原反应的是________(填写序号)。
(4)反应 = 4 \* GB3 ④的离子方程式是:_________________________________________。
(5)将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是:
___________________________________________。
四、填空题(本题包括4小题,共32分)
23.(8分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3- +4H++3e- = NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:_______________________________________。
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2 mol气体,则转移电子的物质的量是 mol。
(4)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
。
24.(4分)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+ 、Cl-、Mg2+、Ba2+、CO32 -、SO42 -,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04 mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是( )
(A)K+一定存在 (B)100 mL溶液中含0.01 mol CO32 -
(C)Cl-可能存在 (D)Ba2+一定不存在,Mg2+可能存在
25.(10分)U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为___________ ___;XW的电子式为__________________;Z元素在周期表中的位置是______ ___。
(2)U元素形成的同素异形体的晶体类型可能是(填序号)________________。
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)__________;V、W的氢化物分子结合H+能力较强的是(写化学式)_________ _,用一个离子方程式加以证实______________________________ _ ____。
(4)YW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为________________ __。
由此可知VW和YW2还原性较强的是(写化学式)_________ ___。
26. (10分)工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。请按要求回答下列问题:
(1)将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式____________________ __、
______________________________________ ___。
(2)在尾气与氨水反应所得到的高浓度溶液中,按一定比例加入氨水或碳酸氢铵,此时溶液的温度会自行降低,并析出晶体。
①导致溶液温度降低的原因可能是___________________________________________;
②析出的晶体可用于造纸工业,也可用于照相用显影液的生产。已知该结晶水合物的相对分子质量为134,则其化学式为________ _____;
③生产中往往需要向溶液中加入适量的对苯二酚或对苯二胺等物质,其目的是_________________________ _____。
(3)能用于测定硫酸尾气中SO2含量的是_______ __。(填字母)
(A)NaOH溶液、酚酞试液 (B)KMnO4溶液、稀H2SO4
(C)碘水、淀粉溶液 (D)氨水、酚酞试液
五、计算题(本题包括1小题,共8分)
27.(8分)2 g Cu2S和CuS的混合物在酸性溶液中用400mL 0.075 mol/L KMnO4溶液处理,发生反应如下:
8 MnO4-+5 Cu2S +44 H+=10Cu2+ + 5SO2 + 8 Mn2+ + 22 H2O
6 MnO4-+5 CuS +28 H+= 5Cu2+ + 5 SO2 + 6 Mn2+ + 14 H2O
反应后煮沸溶液,赶尽SO2,剩余的 KMnO4恰好与350 mL 0.1 mol/L (NH4)2Fe(SO4)2 溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
(2)KMnO4溶液与混合物反应,消耗KMnO4的物质的量为 mol。
(3)欲配制500mL 0.1mol/L NH4 溶液,需称取 (NH4)2Fe(SO4)2·6H2O
(M=392g/mol)的质量为 g。
(4)混合物中 Cu2S的质量分数为 。(该小题请写出解题过程)
08届高三期中化学模拟试卷答案
第Ⅰ 卷(选择题,共60分)
一、选择题(每题只有一个选项符合要求, 每小题3分,共60分)
题号
1
2
3
4
5
6
7
8
9
10
答案
A
A
D
A
B
B
C
A
B
C
题号
11
12
13
14
15
16
17
18
19
20
答案
D
C
A
D
A
C
B
A
A
D
第Ⅱ卷(非选择题,共60分)
二、实验题(本题包括1小题,共10分)
21.[答案](1)检查装置气密性;(2)Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O; 反应变缓,气体颜色变淡; (3)丙;耗酸量最少,无污染。 (4)向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸; c中有黄绿色气体产生,d中溶液变为黄棕色; 没有处理尾气。
三、推断题(本题包括1小题,共10分)
22.[答案](1)四(或4);Ⅷ。 (2)1:2。 (3) = 3 \* GB3 ③。 (4)3Fe2++NO3- +4H+ = 3Fe3++NO↑+2H2O。 (5)Fe2O3+3KNO3+4KOH ![]() 2K2FeO4+3KNO2+2H2O。
2K2FeO4+3KNO2+2H2O。
四、填空题(本题包括4小题,共32分)
23.[答案](1)14HNO3+3Cu2O = 6Cu(NO3)2+2NO↑+7H2O。 (2)酸性; 氧化性。 (3)0.6 mol (4)使用了较浓的硝酸,产物中有部分二氧化氮生成。
24.[答案]AC。[提示]据(2)知NH4+ 有0.04 mol。据(3)知:①BaSO4有2.33 g(即0.01 mol),即有0.01 mol SO42 -; ②有BaCO3为3.94 g(即0.02 mol),即CO32 -有0.02 mol;③Ba2+、Mg2+不会存在,Cl-可能存在。由于n(NH4+ )<2n(CO32 -)+2n(SO42 -),由电荷守恒可知,必有K+。
25.[答案](1)N≡N; ![]() ;第四面期,第 = 8 \* ROMAN VIII族。 (2)①③。
;第四面期,第 = 8 \* ROMAN VIII族。 (2)①③。
(3)CH4;NH3;NH3+H3O+= NH4+ +H2O。
(4)3SO2+3Ba2++2H2O+2NO3- = 3BaSO4↓+2NO↑+4H+。 SO2。
26.[答案](1)2SO2+O2+2H2O = 2H2SO4(或2H2SO3+O2 = 2H2SO4);
2(NH4)2SO3+O2 = 2(NH4)2SO4; 2NH4HSO3+O2 = 2NH4HSO4(任写两个)。
(2)①反应吸热;②(NH4)2SO3·H2O;③防止 4的硫被氧化。 (3)BC。
五、计算题(本题包括1小题,共8分)
27.[答案]
(1) 1MnO4-+ 5Fe2++ 8H+= 1 Mn2++ 5 Fe3 + 4H2O
(2) 0.023 mol (3) 9.8 g (4) 40%
| |