| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
6.下列溶液中,有关离子一定能大量共存的是 A.在强碱的溶液中:K+、S2—、SO42—、ClO- B.能使石蕊呈蓝色的溶液中: Na 、I-、Cl-、NO3— C.在pH=1的溶液中:NH4 、Mg2 、SO32—、NO3— D.含有大量Al3 的溶液中:NH4 、Na 、Cl-、HCO3— 7.臭氧O3可以使湿润的淀粉碘化钾试纸变蓝,化学反应式为: 2KI O3 H2O =2 KOH I2 O2 ;下列叙述中正确的是: A.O3在反应中被氧化成O2 B.反应中氧化产物O2与还原产物I2的物质的量之比为1:1 C.H2O是氧化剂 D.该反应中的还原产物是KOH 8.A、B、C、D、E均为短周期元素。A、B、C位于同一周期相邻位置,它们分别与D形成的分子中都有10个电子,且A和C的原子序数之比为3︰4。E原子半径是短周期元素原子半径最大的。则下列叙述正确的是 A.A和C能形成共价化合物 B.由B、D原子构成的分子的结构是正四面体 C.E和C只能形成E2C 一种化合物 D.由A、B、C、D四种元素形成的化合物一定不属于无机盐 9.关于非金属元素N、C、Si的叙述中正确的是 A.它们都能以游离态存在于自然界 B.它们的氧化物都能与强碱反应生成含氧酸盐 C.气态氢化物的稳定性为CH4>SiH4 D.N2和C在一定条件下分别与足量的O2反应,其△H都大于零 10.已知:1mol 肼(N2H4)(g)与NO2在一定条件下,完全反应生成N2(g)和水蒸气放出567.85 kJ的热量。下列关于肼和NO2反应的热化学方程式中,正确的是: A.2N2H4(g) 2NO2(g) = 3N2(g) 4H2O(l);△H = – 1135.7 kJ/mol B.2N2H4(g) 2NO2(g) = 3N2(g) 4H2O(g);△H = 1135.7kJ/mol C.N2H4 NO2 = 3/2N2 2H2O ;△H = –567.85kJ/mol D.2N2H4(g) 2NO2(g) = 3N2(g) 4H2O(g);△H = – 1135.7 kJ/mol 二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错一个,该小题就为0分) 11.对氨水溶液中存在的电离平衡NH3·H2O A.加水后,溶液中n(OH—)增大 B.加入少量浓盐酸,溶液中n(OH—)增大 C.加入少量浓NaOH溶液,电离平衡向正反应方向移动 D.加入少量NH4Cl固体,溶液中c(NH4 )减少 12.用NA表示阿伏加德罗常数,下列叙述正确的是 A.46g四氧化二氮含有的原子总数为3NA B.20gD2O中含有D—O键的数目为NA C.1molNH4NO3晶体中约含有NH4 6.02×1023个 D.2molFeC13制成胶体,所得氢氧化铁胶体的胶粒数为2NA 13.下列离子方程式中错误的是 A.将SO2气体通入NaClO溶液中:SO2+2ClO-+H2O====SO B.FeBr2溶液中通入过量Cl2:2Fe2 4Br- 3Cl2=2Fe3 2Br2 6Cl-
2H++SO D.NH4HCO3溶液与过量NaOH溶液反应:NH 14.T℃时,在恒容密闭容器中,A、B、C三种气体反应浓度变化如图所示(a);若其他条件不变,温度分别为T1和T2时,B的含量变化如图(b)。则下列说法正确的是
A.达到平衡后,升高温度,正、逆反应速率和A的转化率均增大 B.达到平衡后,保持其他条件不变,增大压强,平衡向逆反应方向移动 C.达到平衡后,保持压强不变,通入稀有气体,平衡向正反应方向移动 D、T℃时,若在该容器中由0.4mol/LA、0.4mol/LB和0.2mol/LC恒容开始反应,达到平衡后,C的浓度仍为0.4mol/L 15.锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为 负极反应:C6Li-xe-===C6Li1-x+xLi (C6Li表示锂原子嵌入石墨形成的复合材料) 正极反应:Li1-xMO2+xLi +x e-===LiMO2(LiMO2表示含锂的过渡金属氧化物) 下列有关说法不正确的是 A.锂离子电池充电时电池反应为C6Li+Li1-xMO2===LiMO2+C6Li1-x B.电池反应中,若锂、锌分别各失去1mol电子,金属锂所消耗的质量小 C.锂离子电池放电时电池内部Li 向负极移动 D.锂离子电池充电时阴极反应为C6Li1-x+xLi +x e-===C6Li 16.室温下,下列混合溶液中,各离子浓度的关系正确的是 A、pH=12的氨水溶液与pH=2的盐酸溶液等体积混合 c(NH4 )﹥c(Cl—)﹥c(OH—)﹥c(H ) B、浓度均为0.1mol/L的硫酸氢铵溶液与氢氧化钠溶液等体积混合 c(Na )﹥c(SO42—)﹥c(NH4 )﹥c(H )﹥c(OH—) C、浓度为0.1mol/L的碳酸钠溶液 c(Na ) c(H )=2c(CO32—) c(OH—) D、浓度为0.1mol/L的醋酸钠溶液 c(Na )=c(CH3COO—)﹥c(OH—)= c(H ) 17.在相同条件下,现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序为: ①50mL0.01mol/LCaCl2溶液 ②50mL0.01mol/L的氨水 ③50mL0.01mol/LAgNO3溶液 ④50mL蒸馏水 A. ②>①>③>④ B.②>④>③>① C.④>②>①>③ D.④>③>②>①
代谢类类固醇,其结构简式如右图所示。下列关于诺龙 性质的说法中不正确的是 A.能与氢气反应 B.能与金属钠反应 C.能与NaOH溶液反应 D.能与新制Cu(OH)2悬浊液反应 19.几种短周期元素的原子半径及主要化合价如下表:
| 元素代号
| L
| M
| X
| R
| T
| 原子半径/nm
| 0.160
| 0.143
| 0.102
| 0.089
| 0.074
| 主要化合价
| 2
| 3
| 6、-2
| 2
| -2 |
下列叙述正确的是
A.R的氧化物对应的水化物可能具有两性
B.X单质可在氧气中燃烧生成XO3
C.离子半径大小:r (M3 )<r (T2-)
D.L2 和X2-的核外电子数相等
20.向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出0.06 mol NO,往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的原混合物,能得到铁的物质的量为
A.0.24mol B.0.21mol C.0.16mol D.0.14mol
第Ⅱ卷 非选择题(共80分)
三、(本题包括3小题,共29分)
21.(4分)下列实验操作或事故处理中,正确的做法是
A.银镜反应实验后附有银的试管,可用稀H2SO4清洗
B.在粗盐的提纯实验中,溶解、过滤、蒸发都用到了玻璃棒
C.实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室。
D.配制FeCl3溶液时,将FeCl3固体溶于较浓盐酸中,然后再用水稀释到所需的浓度
E.制取乙酸乙酯时,先将乙醇和乙酸混合后再沿烧杯内壁缓慢注入浓硫酸中。
F.取1mL 20%蔗糖溶液,加入适量稀硫酸,水浴加热约5min后,再加入少量新制的
Cu(OH)2,加热,可检验蔗糖是否发生水解。
G.为了测定某溶液的pH,将用蒸馏水润湿的pH试纸浸入到待测溶液中,过一会取出,与标准比色卡进行对比
22.(15分)某教科书对“铝热反应”实验的现象有这样的描述:“反应放出大量的热,并发出刺眼的光线”,“纸漏斗的下部被烧穿,有熔融物落入沙中”。已知:Al、Fe的熔点、沸点数据如下:
物质
Al
Fe
熔点(℃)
660
1535
沸点(℃)
2467
2750
(1)某同学猜测,铝热反应所得到的熔融物是铁铝合金。根据已有知识找出一种验证产物中有Fe的方法: 。
(2)设计一个简单的实验方案,证实上述所得的熔融物中含有金属铝。请填写下列表格:
所用试剂
实验操作及现象
有关反应的化学方程式
(3)实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
 ①图中OC段没有沉淀生成,此阶段发生反应的离子方程式为 。
①图中OC段没有沉淀生成,此阶段发生反应的离子方程式为 。
②在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式
为 ;
③B与A的差值为 mol。
23.(10)KMnO4溶液常用做氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此精确配制KMnO4标准溶液的操作是:
(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸l h;
(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;
(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处:
(4)利用氧化还原滴定方法,在70℃-80℃条件下用基准试剂(纯度高、稳定性好的物质)溶液测定其浓度。
回答下列问题:
(1)为什么要称取稍多于所需的KMnO4固体?___________________________
(2)如何保证在70℃~80℃条件下进行滴定操作:_______________________
(3)下列物质中,可以用于测定KMnO4溶液浓度的基准试剂是________(填写序号)
A.H2C2O4·2H2O B.FeSO4·7H2O C.浓盐酸 D.Na2SO3
(4)若准确称取W g草酸晶体(H2C2O4·2H2O)溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液V mL。
6H++2MnO4-+5H2C2O4·2H2O====2Mn2++10CO2↑+18H2O,问:
①滴定时,高锰酸钾溶液应装在________________;
②滴定终点标志是__________________;
③KMnO4溶液的物质的量浓度为__________________:
④若滴定前平视,滴定后俯视,则测得的浓度值将________(填“偏高”或偏低)
四、(本题包括3小题,共31分)
24.(10分)工业上合成氨是在一定条件下进行如下反应:
N2(g) 3H2(g) ![]() 2NH3(g),△H = -92.44kJ/mol;其部分工艺流程如下:
2NH3(g),△H = -92.44kJ/mol;其部分工艺流程如下:
|
催化剂 高温、高压 |
|
N2、H2 |
|
氮气 |
|
氢气 |
|
混合气 |
|
产品 |
|
净化 |
|
循环气体 |
|
压缩 |
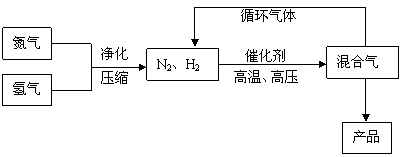 |
反应体系中各组分的部分性质见下表:
气体
氮气
氢气
氨
熔点(℃)
-210.01
-252.77
-77.74
沸点(℃)
-195.79
-259.23
-33.42
回答下列问题:
(1)写出该反应的化学平衡常数表达式:K= 。随着温度的升高,K值 (填增大、减小、不变)。
(2)平衡常数K值越大,表明 (填序号)。
A.N2的转化率越高 B.NH3的产率越大
C.原料中N2的含量越高 D.化学反应速率越快
(3)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 使 分离出来;继续循环的气体是 。
25.(10分)我国规定饮用水质量标准必须符合下列要求:
PH值
6.5-8.5
Ca2 ,Mg2 总浓度
< 0.0045mol/L
细菌总数
< 100个/mL
以下是源水处理成自来水的工艺流程示意图

(1)源水中含Ca2 、Mg2 、HCO3—、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式____ _________
(2)凝聚剂除去悬浮固体颗粒的过程__________(填写编号,多选倒扣)
①只有物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4·7H2O常用的凝聚剂,它在水中最终生成_____ ______沉淀。
(3)通入二氧化碳的目的是__________ _______和_______ ______。
(4)气体A通常使用氯气,氯气的作用是基于其和水反应的产物之一具有______________性,请写出氯气与水反应的离子反应方程式 。
(5)下列物质中能作为氯气的代用品的是 (填写编号,多选倒扣)
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2
26.(11分)空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
|
海水 |
|
苦卤 |
|
提取粗盐 |
|
= 1 \* GB3 ①硫酸酸化 = 2 \* GB3 ②氯气氯化 |
|
含Br2的 海水 |
|
= 3 \* GB3 ③空气吹出 |
|
含Br2的 空气 |
|
= 4 \* GB3 ④SO2吸收 |
|
吸收液 |
|
= 5 \* GB3 ⑤ 氯化 |
|
溴水 混合物 |
|
= 6 \* GB3 ⑥ 蒸馏 |
|
溴蒸气 |
|
液溴 |
|
= 7 \* GB3 ⑦ 冷凝 = 8 \* GB3 ⑧ 分离 |
|
粗溴水 |
 |
(1) 溴在周期表中位于_________周期,_________族。
(2) 步骤 = 1 \* GB3 ①中用硫酸酸化可提高Cl2的利用率,为什么? 。
(3) 步骤 = 4 \* GB3 ④的离子方程式:________________________________________ 。
(4) 步骤 = 8 \* GB3 ⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是_____________,分离时液溴从分离器的_____(填“上口”或“下口”)排出。
(5)为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”: 。
五、(本题包括1小题,共10分)
27.(10分)(1)苯、四氯化碳、乙醇、汽油是常见的有机溶剂,能与水互溶的是 ;不溶于水,且密度比水小的是 。
(2)一瓶无色气体,可能含有CH4和CH2==CH2,或其中的一种,与一瓶Cl2混合后光照,观察到黄绿色逐渐褪去,瓶壁有少量无色油状小液滴。
①由上述实验现象推断出该瓶气体中一定含有CH4,你认为是否正确,为什么?
。
②上述实验可能涉及的反应类型有 。
(3)含有 ![]() 的化合物与CH2==CH2一样,在一定条件下可聚合成高分子化合物。
的化合物与CH2==CH2一样,在一定条件下可聚合成高分子化合物。
①广泛用作农用薄膜的聚氯乙烯塑料,是由 ![]() 聚合而成的,其化学方程式是
聚合而成的,其化学方程式是
。
②电器包装中大量使用的泡沫塑料的主要成份是聚苯乙烯 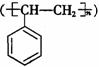 ,它是由 (写结构简式)聚合而成。
,它是由 (写结构简式)聚合而成。
六、(选做题,本题共10分)
考生注重:
28、29题为选做题,考生可任选一题。先在答题卡指定位置填写你所选择的试题号,再按要求答题,假如不填试题号,一律按0分计。28题适合选修《有机化学基础》模块的考生解答,29题适合选修《物质结构与性质》模块的考生解答。
28.(10分)化学工作者正在研究以天然气和醇类合成优质汽油的方法。已知:
|
R-CH2-CHO + R1-CH2-CHO R-CH2-CH-CH-CHO |
|
OH |
|
NaOH溶液 |
|
R1 |
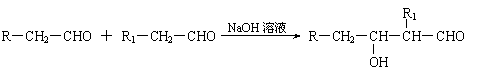 (1)凡与醛基直接相连的碳原子上的氢称为α—H原子,在稀碱溶液的催化作用下,一个醛分子上的α—H原子连接到另一个醛分子中醛基的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:
(1)凡与醛基直接相连的碳原子上的氢称为α—H原子,在稀碱溶液的催化作用下,一个醛分子上的α—H原子连接到另一个醛分子中醛基的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:
|
2R-CH2-Cl + 2Na R-CH2-CH2-R + 2NaCl |
|
一定条件 |
|
CH3-CH=CH2 + H-Cl CH3-CH-CH3 |
|
Cl |
|
一定条件 |
 |
(3)
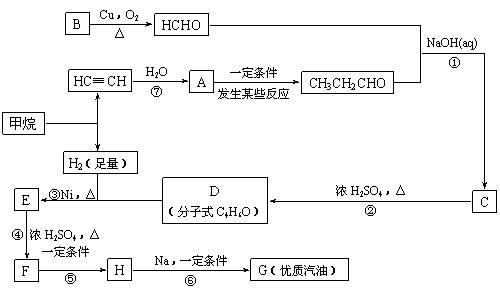
合成路线如下:
|
甲烷 |
|
B |
|
H2(足量) |
|
E |
|
③Ni,△ |
|
D (分子式C4H6O) |
|
④ 浓H2SO4,△ |
|
F |
|
H |
|
G(优质汽油) |
|
⑤ |
|
Na,一定条件 ⑥ |
|
浓H2SO4,△② |
|
HC≡CH |
|
H2O ⑦ |
|
A |
|
一定条件 发生某些反应 |
|
CH3CH2CHO |
|
Cu,O2 △ |
|
HCHO |
|
NaOH(aq) ① |
|
C |
|
一定条件 |
 |
填空:
(1)在反应②~⑦中,属于加成反应的是 ,属于消去反应的是 。
(2)写出下列反应方程式
E → F: ;
H → G: 。
(3)H也能与NaOH溶液反应,其反应方程式为:
,
生成的有机物能否在Cu或Ag作催化剂的条件下被空气氧化 (选填“能”或“否”)。
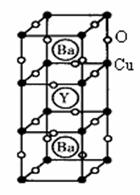 29.(10分)新型节能材料高温超导体的最先突破是在1987年
29.(10分)新型节能材料高温超导体的最先突破是在1987年
从新的钇钡铜氧材料的研究开始的。钇钡铜氧的晶胞结构如图。研究发现,此高温超导体中的铜元素有两种价态:+2价和+3价(铜元素的原子序数为29)。
(1)写出铜在周期表中的位置(周期和族)
(2)写出Cu3 的核外电子排布:
(3)根据图示晶胞结构,推算晶体中Y,Cu,Ba和O原子个数比,确定其化学式为:
。
(4)根据(3)所推出的化合物的组成及各元素的化合价 (该化合物中Y、 Ba元素的化合价分别为+3价、+2价),计算化合物中两种价态Cu原子个数比为: 。
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到的[Cu(NH3)4]SO4晶体中含有的化学键除了普通共价键外,还有 和 。
高三二模试题参考答案
一、二选择题(1-10小题每小题只有一个正确答案,每小题3分,10小题共30分;本题11-20小题,每小题4分,共40分。每小题有个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只先一个且正确的得2分,选两个且都正确的得4分,但只要选错一个,该小题就为0分))
|
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
答案 |
B |
C |
B |
B |
A |
B |
D |
A |
C |
D |
|
题号 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
答案 |
A |
AC |
AD |
D |
AC |
A |
B |
CD |
AC |
B |
三、(本题包括3小题,共29分)
21、(4分)B、D。答对一个得2分,答错到扣,直至该小题为0分。
22、(15分)
(1)用磁铁吸引,若能吸附,说明有铁生成(3分)
(2)(共6分)
所用试剂
NaOH溶液(1分)
实验操作及现象
取少量样品放入试管(1分),加入NaOH溶液(1分),若有气泡产生(1分),说明该熔融物中有铝。
有关反应的化学方程式
![]()
![]()
![]() (2分)化学式全对给1分,配平和箭头共1分,只要有化学式错得0分
(2分)化学式全对给1分,配平和箭头共1分,只要有化学式错得0分
(其它答案若合理且完全正确酌情给分)
(3)①H OH-=H2O(2分)②NH4 OH-=NH3·H2O (2分) ③0.008 (2分)
23、(共l 0分)
(1)有部分KMO4被还原成MnO(OH)2 (1分)
(2)可在水浴中加热 (1分)
(3)A (1分)
(4)酸式滴定管(2分),当最后滴下1滴KMnO4溶液后半分钟不褪色时(1分) 10w/63V (2分)偏高 (2分)
四、(本题包括3小题,共31分)
|
c (NH3)2 |
|
c(N2)·c(H2)3 |
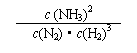 24.(10分)(1) (2分),减小(2分)
24.(10分)(1) (2分),减小(2分)
(2) A B (2分)
写对1个给1分,写对2个给2分,写错1个扣1分,但不出现负分,
(3)-33.42℃或-33.42℃以下(1分), 氨(1分), N2,H2(2分)
25.(10分)
(1)HC ![]() OH-→C
OH-→C ![]() H2O ; Mg2 2OH-→Mg(OH)2↓
H2O ; Mg2 2OH-→Mg(OH)2↓
Ca2 HC ![]() OH-→CaCO3↓ H2O (2分,任选其一,其他合理答案也给分)
OH-→CaCO3↓ H2O (2分,任选其一,其他合理答案也给分)
(2) ③ ; 胶状Fe(OH)3 (各1分 共2分)
(3) 除去Ca2 ; 调节PH值 (各1分 共2分)
(4) 强氧化,Cl2 H2O=H Cl- HClO (各1分 共2分)
(5) ① ③ (各1分,共2分,答错一个倒扣1分,该问不出现负分。)
26、(1)4 VIIA (2分)
(2)酸化可防止Cl2 、Br2与水反应 (2分)
(3)Br2 SO2 2H2O=4H 2Br- SO42- (2分)
(4)分液漏斗 下口 (2分)
(5)氯化后的海水虽然含有溴单质,但浓度低,假如直接蒸馏原料,产品成本高。(2分) “空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程。(1分)
五、(本题包括1小题,共10分)
27、(共10分)
(1)乙醇(1分);苯,汽油(2分)
(2)①不正确,因为CH2==CH2也可以与Cl2发生加成反应,而使黄绿色逐渐褪去,生成的CH2ClCH2Cl也是油状液体。(2分)
②取代反应,加成反应(2分)
(3)① 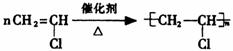 (2分)②
(2分)② 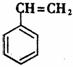 (1分)
(1分)
六、(选做题,本题共10分)
28、29题为选做题,考生可任选一题。先在答题卡指定位置填写你所选择的试题号,再按要求答题,假如不填试题号,一律按0分计。28题适合选修《有机化学基础》模块的考生解答,29题适合选修《物质结构与性质》模块的考生解答。
28、[共10分,第(1)小题各1分,其它每空2分]
⑴ ③⑤⑦ (1分); ②④ (1分)
|
CH3-CH-CH3 |
|
CH2OH |
|
CH3-C-CH3 |
|
CH2 |
|
浓H2SO4 △ |
|
↑ H2O |
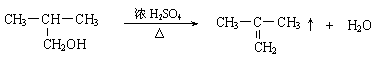
|
|
CH3-C-CH3 2Na 2NaCl |
|
Cl |
|
CH3 |
|
CH3-C-C-CH3 |
|
H3C |
|
H3C |
|
CH3 |
|
CH3 |
|
一定条件 |
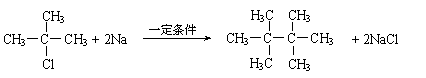 | |||
| |||
⑶
|
CH3-C-CH3 NaOH NaCl |
|
Cl |
|
CH3 |
|
H2O △ |
|
CH3-C-CH3 |
|
OH |
|
CH3 |
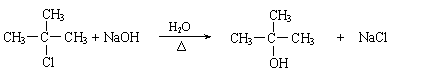 | |||
| |||
否 (2分)
29、(1)第四面期, = 1 \* ROMAN IB族;(2分)
(2)[Ar]3d8 或1s22s22p63s23p63d 8 (2分)
(3)YBa2Cu3O7 (2分)
(4)Cu2 :Cu3 =2:1 (2分)
(5)离子键,配位键 (2分)
| |