| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
B.生成的氢化物分子间均可形成氢键 C.A与C形成的阴离子可能有AC D.A、B、C、D的单质常温下均不导电 14. 反应 aX(g) bY(g)
 A.a b>c,Q<0 A.a b>c,Q<0
B.a b>c,Q>0 C.a b<c,Q<0 D.a b<c,Q>0 15.三容器内分别装有相同压强下的NO、NO2、O2,设三容器容积依次为V1、V2、V3,若将三气体混合于一个容积为V1 V2 V3的容积中后,倒立于水槽中,最终容器内布满水。则V1、V2、V3之比不可能是 A.3∶7∶4 B.5∶7∶6 C.7∶3∶6 D.1∶1∶1
第四次摸底考试 命题人 刘焕山 可能用到的相当原子质量:H—1 O—16 C—12 N—14 S—32 Cl—35.5 Na—23 Ca—40 Fe—56 一、选择题(共15小题,每题只有1个正确答案,每小题3分)
| 1
| 2
| 3
| 4
| 5
| 6
| 7
| 8
| 9
| 10
| 11
| 12
| 13
| 14
| 15
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| | ||||||||||||||||||||||
二、(共55分)
16.(5分)下面a~e是中学化学实验中常见的几种定量仪器:
(a)量筒 (b)容量瓶 (c)滴定管 (d)托盘天平 (e)温度计
(1)其中标示出仪器使用温度的是 (填写编号)
(2)由于操作错误,使得到的数据比正确数据偏小的是 (填写编号)
A.实验室制乙烯测量混合液温度时,温度计的水银球与烧瓶底部接触
B.中和滴定达终点时俯视滴定管内液面读数
C.使用容量瓶配制溶液时,俯视液面定容所得溶液的浓度
(3)称取10.5g固体样品(1g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为 g。
17.(10分)
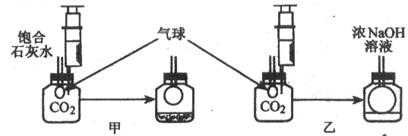
【发现问题】研究性学习小组中的小张同学在学习中发现:通常检验CO2用饱和石灰水,吸收CO2用浓NaOH溶液。
【实验探究】在体积相同盛满CO2的两集气瓶中,分别加入等体积的饱和石灰水和浓NaOH溶液。
实验装置和现象如图所示。请你一起参与。
|
【现象结论】甲装置中产生该实验现象的化学方程式为 。
解释通常用石灰水而不用NaOH溶液检验CO2的原因
;乙装置中的实验现象是 。
吸收CO2较多的装置是 。
【计算验证】另一位同学小李通过计算发现,等质量的Ca(OH)2和NaOH吸收CO2的质量,Ca(OH)2大于NaOH。因此,他认为通过吸收CO2应该用饱和石灰水。
【思考评价】请你对小李同学的结论进行评价:
。
|
资料:常温常压下,硫化氢(H2S)是一种无色气体,具有臭鸡蛋气味,饱和硫化氢溶液的物质的量浓度约为0.1mol·L-1。硫化氢剧毒,经粘膜吸收后危害中枢神经系统和呼吸系统,对心脏等多种器官造成损害。硫化氢的水溶液称氢硫酸(弱酸),长期存放会变浑浊。硫化氢及氢硫酸发生的反应主要有: 2H2S O2=2H2O 2S 2H2S 3O2=2H2O 2SO2 2H2S SO2=2H2O 3S 2H2S Cl2=2HCl S↓ H2S=H2 S H2S CuSO4=CuS↓ H2SO4 H2S 2NaOH=Na2S 2H2O H2S NaOH=NaHS H2O …… |
 18.(12分)下面是关于硫化氢的部分文献资料
18.(12分)下面是关于硫化氢的部分文献资料
某研究性学习小组对资料中“氢硫酸长期存放会变浑浊”这一记载十分感爱好,为了探究其原因,他们分别做了如下实验:
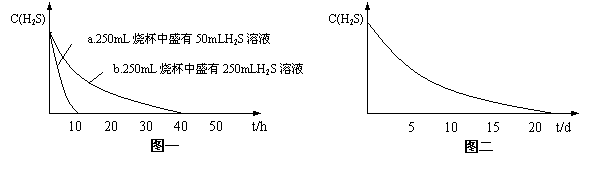
实验一:将H2S气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中放置1~2天未见浑浊现象。用相同浓度的碘水去滴定氢硫酸溶液测其浓度。图一所示为两只烧杯中氢硫酸浓度随时间变化而减小的情况。
实验二:密闭存放的氢硫酸,天天定时取1mL氢硫酸,用相同浓度的碘水滴定,图二所示为氢硫酸浓度随放置天数变化的情况。
|
10 20 30 40 50 |
|
t/h |
|
C(H2S) |
|
a.250mL烧杯中盛有50mLH2S溶液 |
|
b.250mL烧杯中盛有250mLH2S溶液 |
|
图一 |
|
图二 |
|
5 10 15 20 t/d |
|
C(H2S) |
|
空气→ |
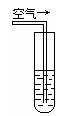 实验三:在饱和氢硫酸溶液中以极慢的速度通入空气(1~2个气泡/min),数小时未见变浑浊的现象。
实验三:在饱和氢硫酸溶液中以极慢的速度通入空气(1~2个气泡/min),数小时未见变浑浊的现象。
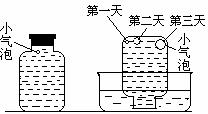 实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶液隔2~3天观察,直到略显浑浊;当把满瓶的氢硫酸倒扣在培养皿中观察2~3天,在溶液略显浑浊的同时,瓶底仅聚集有少量的气泡,随着时间的增加,这种气泡也略有增多(大),浑浊现象更明显些。请回答下列问题:
实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶液隔2~3天观察,直到略显浑浊;当把满瓶的氢硫酸倒扣在培养皿中观察2~3天,在溶液略显浑浊的同时,瓶底仅聚集有少量的气泡,随着时间的增加,这种气泡也略有增多(大),浑浊现象更明显些。请回答下列问题:
(1)实验一(见图一)中,氢硫酸的浓度随时间变化而减小的主要因素是_________ 。
(2)实验一和实验二中,碘水与氢硫酸反应的化学方程式为__________ 。两个实验中准确判定碘水与氢硫酸恰好完全反应是实验成功的要害。请设计实验方案,使实验者准确把握所加碘水恰好与氢硫酸完全反应_____ __
___ _______ 。
(3)“氢硫酸长期存放会变浑浊”中,出现浑浊现象是由于生成了_____ __的缘故。
(4)该研究性学习小组设计实验三,说明他们认为“氢硫酸长期存放会变浑浊”的假设原因之一是(用文字说明)________________ ______。此实验中通入空气的速度很慢的主要原因是什么?___________________ ____________。
(5)实验四的实验现象说明“氢硫酸长期存放会变浑浊”的主要原因可能是____ _____。为进一步证实上述原因的准确性,你认为还应做哪些实验(只需用文字说明实验设想,不需要回答实际步骤和设计实验方案)?______________________ _______________。
19.(10分)已知A、B、C、D、X、Y六种物质均由短周期元素组成,其中X为常见离子化合物,它们之间的转换关系如下图所示
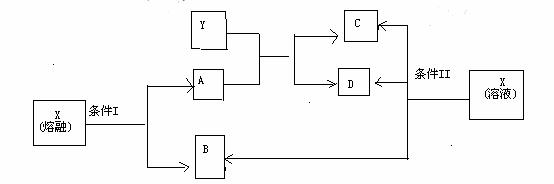
(1)已知条件I和条件II相同,则该反应条件为
(2)物质X的电子式为
(3)写出B与Ca(OH)2反应的化学方程式
(4)写出X在条件II下反应生成B、C、D的离子方程式
(5)写出实验室制B的化学方程式,并标出电子转移方向、数目
(6)请简述鉴定物质X的实验方法
20.(10分)有机物A(C10H20O2)具有兰花香味,可用作香皂、洗发香波的芳香赋予剂。已知:
①B分子中没有支链
②D能与碳酸氢钠溶液反应放出二氧化碳
③D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被氯取代,其一氯代物只有一种。
④F可以使溴的四氯化碳溶液褪色。
(1)B可以发生的反应有 (选填序号)
①取代反应 ②消去反应 ③加聚反应 ④氧化反应
(2)D、F分子所含的官能团的名称依次是 、 。
(3)写出与D、E具有相同官能团的同分异构体的可能结构简式: 、
、 、 。(可不填满,也可补充)
(4)E可用于生产氨苄青霉素等。已知E的制备方法不同于其常见的同系物,据报道,可由2-甲基-1-丙醇和甲酸在一定条件下制取E。该反应的化学方程式是:
。
21.(8分) 将一定质量的铁粉加入到装有100 ml某浓度的稀硝酸溶液中充分反应。
(1)容器中剩有m g的铁粉,收集到NO气体448 ml(标准状况下)。
①所得溶液中的溶质的化学式是______________;
②原硝酸溶液的物质的量浓度为:________________ mol/L。
(2)向上述固-液混合物中逐滴加入稀硫酸直到刚好不再产生气体为止,该气体遇空气变成红棕色。此时容器中有铁粉n g。
①此时溶液中溶质的化学式是 ____________ ;
②m-n的值为(计算精确到0.1g)____________ g 。
第四次摸底考试答案
一、选择题(共15小题,每题只有1个正确答案,每小题3分)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
D
B
A
D
B
C
A
C
D
A
C
C
C
A
B
二、共55分
16.(5分)(1)a、b、c (2)B (3)9.5g
17.(10分 每空2分)
CO2+Ca(OH)2=CaCO3↓+H2O(CO2适量)CO2和石灰水作用有明显的现象,和NaOH作用无明显现象; 气球体积增大,溶液不变浑浊。 乙 因为Ca(OH)2的溶解度较小,所形成的饱和石灰水中溶质的质量分数很小。
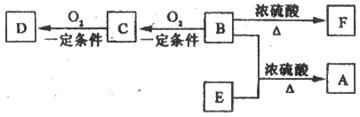
18.(12分)
(1)硫化氢的挥发(1分)。
(2)H2S I2==2HI S↓(1分)向氢硫酸中加入淀粉液,滴加碘水到溶液刚好呈蓝色(2分)。
(3)S或硫(2分)。
(4)氢硫酸被空气中氧气氧化(1分);防止因通入空气过快而使硫化氢大量挥发(2分)。
(5)硫化氢自身分解(1分);确证生成的气体是氢气(2分)。
19.(10分)(1)电解(1分)
(2) ![]() (1分)
(1分)
(3)2Cl2 2Ca(OH)2=CaCl2 Ca(ClO)2 2H2O(1分)
|
(4)2Cl- 2H2O 2OH- H2↑ Cl2↑(2分)
2e-
|
△ |
(5)MnO2 4HCl MnCl2 2H2O Cl2↑(用双线桥表示也可)(2分)
(6)用焰色反应检验Na ;(1分)用硝酸银和稀硝酸检验Cl-(1分)
19.(10分)(1)①②④ (2)羧基 碳碳双键
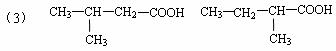
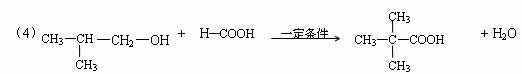
22.(8分)⑴ ①Fe(NO3)2 ② 0.8 ⑵ ①FeSO4 ② 5.0
| |