| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
(1)写出A与水反应的化学方程式 ______________________ 。 (2)元素A与元素D形成一种化合物AD,写出该化合物的电子式 (用元素符号表示) (3)元素B与元素C相比,非金属性较强的是 (用元素符号表示),下列表述中能证实这一事实的是 A.常温下B的氢化物和C氢化物状态不同 B.原子半径B大于C C.一定条件下B和C的单质能发生反应,C被氧化。 (4)探寻物质的性质差异性是学习的重要方法之一。A、B、C、D四种元素的单质中化学性质明显不同于其他三种单质的是 (用元素符号表示),理由 。
(B)现有部分短周期元素的性质或原子结构如下表:
| 元素编号
| 元素性质或原子结构
| A
| 单质能与水剧烈反应,所得溶液呈弱酸性
| B
| L层p电子数和s电子数相等
| C
| 第二周期元素的原子中半径最大
| D
| M层有两个未成对电子 |
(1)写出A与水反应的化学方程式 。
(2)元素B和氢元素形成化合物H4B,写出该化合物的电子式 。
(3)元素A与元素D相比,非金属性较强的是 (用元素符号表示),下列表述中能证实这一事实的是
A、常温下A单质的颜色比D单质的颜色深。
B、A的气态氢化物比D的气态氢化物稳定
C、离子半径,A大于D
(4)探寻物质的性质差异性是学习的重要方法之—。A、B、C、D四种元素的单质中化学性质明显不同于其他三种单质的是 (用元素符号表示),理由 。
24、某一反应体系中有反应物和生成物共五种:S、H2S、HNO3、NO、H2O。已知水是生成物之一。
(1)该反应中的氧化剂是 。(2)该反应中的氧化产物是 。
(3)由已知反应物和生成物,写出该反应的化学方程式,并配平:
_______________________________________________________________
(4)若反应中转移了0.3摩尔电子,则生成水的质量是 。
|
1 |
|
2 |
|
3 |
|
0 t1 t2 t3 t4 t5 t6 t(时间) |
|
物质的量mol |
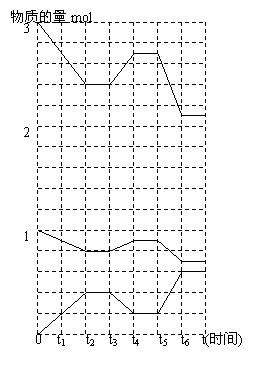
25、在一定条件下,合成氨反应的化学方程式如下:
N2(g) 3H2(g) ![]() 2NH3(g) Q(Q>0)
2NH3(g) Q(Q>0)
(1) 写出该反应的平衡常数表达式
(2)升高温度该反应的K值 ,正反应
速率 ,逆反应速率 ,氢气的转化率
。(填“增大“、“减小”、“不变”)。
(3)右图中处于平衡状态的时间有
。
(4)据图判定,t3时,平衡将向 移动,
t5~t6的曲线变化的原因是 。
A、升高温度 B、增加压强
C、加了NH3 D、加了H2
五、(本题共24分)
考生注重:26题为分叉题,分为A、B两题,考生可任选一题。若两题均做,一律按A题计分。A题适合使用二期课改新教材的考生解答,B题适合使用一期课改教材的考生解答。
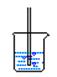
26、(A)以六水合氯化镁(MgCl2·6H2O)为原料制备无水氯化镁。已知:MgCl·6H2O晶体在空气中加热时,释出部分结晶水,同时生成Mg(OH)Cl或MgO;在干燥HCl气流中加热能制得无水MgCl2。
可选用药品:MgCl2·6H2O晶体、NaCl(固)、KClO3(固)、MnO2、浓H2SO4、浓HCl、稀NaOH溶液。 仪器:见下图(装置可重复使用)
![]()

![]()
![]()
A B C D E
(1)实验室制取氯化氢气体的化学方程式 。
(2)按氯化氢气流的方向,由上图中选择合理装置,按字母填入括号,按照选择的装置,从可选药品中选择合理药品填入表中,并在表中注明所选装置和药品的作用。
|
氯化氢气流方向 | |||||
|
装置 |
B |
D |
|||
|
药品 |
不填 |
浓硫酸 |
稀NaOH | ||
|
作用 |
不填 |
不填 |
|||
(3)假如要测定MgCl2·6H2O中的结晶水的数目,需要直接测量的有关物理量(用文字说明) 。
26、(B)课外活动中做测定CuO和Cu混合粉末中氧化铜质量分数的实验,三组同学设计了三种(混合物质量为m克)方法,第一种在实验中对混合物进行来加热,第二种制取了氢气,第三种将混合物与某种液体进行了反应。
实验可能用到的主要仪器:①托盘天平 ②启普发生器 ③硬质玻璃管
④泥三角 ⑤ 烧杯 ⑥坩埚 ⑦酒精灯 ⑧玻棒 ⑨漏斗 ⑩烘箱
实验可能用到的试剂:a.锌粒 b.稀硫酸 c.氯化钠溶液 d,浓硫酸
请你根据题意选择你认为合适的两种方法,按要求填写表格中的有关内容。
实验
方法
实验过程中所发生反应的化学方程式
实验所用仪器
(用编号表示)
实验需直接测定的有关
物理量(用文字说明)
第 种
第 种
27、我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
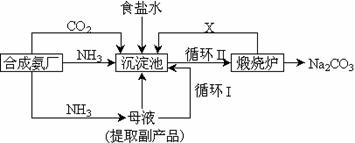
(1)沉淀池中发生的化学反应方程式是 。
(2)上述生产纯碱的方法中,副产品的一种用途为 。
(3)写出上述流程中X物质的分子式 。
(4)从沉淀池中取出沉淀的操作是 。
(5)得到产品碳酸钠中最可能的杂质是 。
A、NH4Cl B、NaHCO3 C、NaCl D、NH4HCO3
(6)为了检验产品纯碱的纯度,利用下图装置测定碳酸钠样品的纯度。已知取样品1.822g,锥形瓶和硫酸(过量)的质量201.076g。每隔相同时间读得电子天平的数据如下表:
|
 |
读数次数 |
质量(g) | ||
|
锥形瓶 H2SO4 试样 |
第1次 |
202.801 | ||
|
第2次 |
202.523 | |||
|
第3次 |
202.220 | |||
|
第4次 |
202.152 | |||
|
第5次 |
202.152 |
计算碳酸钠样品的纯度时,表中必须用到的数据是 ,不必作第6次读数的原因是 ,此碳酸钠样品的纯度 。(精确到0.1%)
![]() 六、(本题共20分)
六、(本题共20分)
28、立方烷的结构简式如图所示
(1)写出它的化学式 。
(2)它的一氯代物有 种,它的二氯代物有三种同分异构体,在下图中画出二氯代物中氯的位置。
(3)写出与立方烷互为同分异构体的属于芳香烃的结构简式 。
(4)等质量的立方烷和下列物质,燃烧时耗氧量相同的是 。
A、苯 B、乙烯 C、甲烷 D、乙炔
29、软性隐形眼镜可由聚甲基丙烯酸羟乙酯(HEMA)制成超薄镜片,其合成线路图如下:
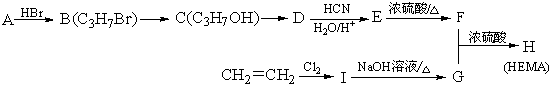
|
(1)(H)R-C=O HCN→(H)R—C—OH |
|
R |
|
R |
|
CN |
|
H2O/H |
|
(H)R—C—OH |
|
R |
|
COOH |
|
R可以是烃基,也可以是H |
 已知:
已知:
(2)CH3COOCH2CH2OH的名称为乙酸羟乙酯。
(3)F的名称是甲基丙烯酸。
试写出:
(1)写出下列反应的反应类型:C→D E→F
(2)写出下列反应方程式:
I→G
G F→H
H→HEMA
(3)写出两种F的同类别的同分异构体的结构简式。
七、(本题共16分)
30、将12.6 g无水亚硫酸钠固体加入100 mL 8 mol/L 的硫酸中以制取SO2气体,反应完全后,若部分SO2气体溶解在溶液中,溶液中含 4价硫元素的物质的总浓度为0.2 mol/L, 假定溶液的体积不变,忽略容器及导管中气体的体积,求:
(1)得到的产物中硫酸钠的物质的量?
(2)溶液中硫元素的质量?(保留1位小数)
(3)收集到SO2气体的体积(标准状态下)为多少毫升?
|
(1)SiO2 2C Si 2CO↑ (2) Si C SiC |
|
电炉高温 |
|
电炉高温 |
(1)若生产过程中参加反应的SiO2和C的质量之比为2:1,则得到的粗硅中,Si和SiC的物质的量之比 。
A、1:1 B、1:2 C、1:3
(2)某粗硅样品中,经测定硅与碳的物质的量之比为3: 1,则样品中单质硅的质量分数 。(保留3位小数)
(3)若SiO2和C的混合物1mol,在高温中充分反应,根据反应方程式,从理论上思考,讨论反应后固体中Si的物质的量(y)和原混合物中C的物质的量(x)之间的关系。
①当x是 mol时,产品中Si的含量最高。
A、1/2 B、1/3 C、2/3 D、3/4
②讨论反应后固体中Si的物质的量(y)和原混合物中C的物质的量(x)之间的关系,填完整下表。
|
x的取值范围 |
y和x的关系式 |
|
y=0.5x | |
|
0.75mol<x<1 mol |
高三化学试卷答题卷
相对原子质量:Ba—137 S—32 C—12 O—16 Na—23 Si—28 S—32 Fe—56
|
一 |
二 |
三 |
四 |
五 |
六 |
七 |
总分 |
第一卷(66分)
一、正确选项只有一个(10分)
|
1 |
2 |
3 |
4 |
5 |
二、正确选项只有一个(36分)
|
6 |
7 |
8 |
9 |
10 |
11 |
|
12 |
13 |
14 |
15 |
16 |
17 |
三、正确选项有一个或二个(20分)
|
18 |
19 |
20 |
21 |
22 |
第二卷(84分)
四、(24分)
23(A)
(1) 。
(2)
(3) (用元素符号表示),
(4) ,理由 。
23(B)
(1) 。
(2) 。
(3) (用元素符号表示),
(4) ,理由 。
24(1) 。 (2) 。
(3)
(4) 。25(1) (2) , , ____, 。(填“增大“、“减小”、“不变”)。
(3) ,
(4)___________________ 、_________
五、(24分)
26(A)(1)实验室制取氯化氢气体的反应方程式 。
(2)
|
氯化氢气流方向 | |||||
|
装置 |
B |
D |
|||
|
药品 |
不填 |
浓硫酸 |
稀NaOH | ||
|
作用 |
不填 |
不填 |
|||
(3) 。
26(B)
实验
方法
实验过程中所发生
反应的化学方程式
实验所用仪器
(用编号表示)
实验需直接测定的有关
物理量(用文字说明)
第__种
第___种
27(1) 。(2) 。
(3) 。(4) 。(5) 。
(6) , , 。
六、(20分)
28
![]()
![]()
![]() (1) 。
(1) 。
(2) 种,
(3) 。(4) 。
29(1)C→D E→F
(2)I→G
G F→H
H→HEMA
(3)写出两种E的同类别的同分异构体的结构简式。
七.(16分)
30、(1)
(2)
(3)
31、
(1) ___
(2) 。(保留3位小数)
(3)① 。
②
|
x的取值范围 |
y和x的关系式 |
|
y=0.5x | |
|
0.75mol<x≤1 mol |
| |