班别_____姓名_____学号_____
一、选择题:(每题只有一个答案,把答案写在答题栏内,每题2分,
共60分)
1.原子核里一定有的微粒是
A.质子 B.质子和电子 C.质子和中子 D.电子
2.1992年发现了三种元素的同
位素,其中一种是208Hg,该原子中所含的中子数为
A.80 B.128 C.208 D.288
3.下列物质中不含共价键的是
A.NaCl B.Cl2 C.HCl D.NaOH
4.关于氨的叙述错误的是
A常温常压下是气体 B.无色 C.无味 D.极易溶于水
5.关于浓硝酸的叙述错误的是
A.易挥发 B.强酸性 C.难溶于水 D.强氧化性
6.下列属于复合肥的是
A.NH4H2PO4 B.NaOH C.NH4NO3 D.K2CO3
7.为了除去铝表面的铜镀层,可选用的试剂是
A.浓H2SO4 B.NaOH溶液 C.浓HCl D.浓HNO3
8.氮气通常用作焊接金属的保护气,填充灯泡,这是因为
A 氮的化学性质稳定 B.氮分子是双原子分子 C.氮气的密度接近空气密度
9.高温超导材料中铊是成分之一,铊是铝的同族元素,关于铊的性质判断错误的是
A.铊是银白色的金属 B.铊能形成+3价的化合物 C.Tl(OH)3具有两性 D.铊能与硝酸反应
10.下列关于氨的用途的说法中错误的是
A.可制硝酸 B.可作致冷剂 C.可制氮肥 D.可制盐酸
11.用氨氧化法制硝酸时,不涉及的反应是
A.NaNO3+H2SO4=NaHSO4+HNO3 B.4NH3+5O2===4NO+6H2O C.2NO+O2===2NO2 D.3NO2+H2O===3HNO3+NO
12.实验室制取氨气时,正确的收集方法是
A.向上排空气法 B.向下排空气法 C.排水法 D.都可以
13.第三周期的非金属元素对应的含氧酸,酸性最强的是
A.硫酸 B.磷酸 C.硅酸 D.高氯酸
14.按周期表中碱金属元素从上到下的顺序,下列描述错误的是
A.原子最外层电子数逐渐增多 B.原子电子层数逐渐增多
C.子失去电子能力逐渐增强 D.金属性逐渐增强
15.下列物质中含有共价键的是
A. HCl B. NaBr C. CaBr D. NaF
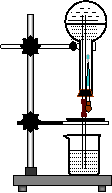
16.下列对16O和和18O的叙述正确的是
A核内电子数均为8 B.核内均含有8个中子
C.互为同位素D.都是氧的同素异形体
17.氮原子的核外电子数为
A.4个 B.5个 C.6个 D.7个
18.下列等式可以成立的是
A. 原子序数=质量数 B.质量数=质子数+中子数
C. 质量数=核外电子数 D.质子数=质量数
19.原子序数为12和16的两种元素,它们最高价氧化物对应的水化物分别是
A.Ca(OH)2 、 H2SO4 B .Mg(OH)2 H2SO4
C.KOH HCl D . Al2(OH)3 H3PO4
20.周期表中VIIA族元素的非金属性变化规律是
A. 自上而下逐渐增强 B.有增有减没有规律
C. 自上而下逐渐减弱 D.从左到右逐渐增强
21.下列晶体属于原子晶体的是
A.食盐 B.干冰 C.二氧化硅 D.冰
22.下列化合物中,既有离子键又有共价键的是
A.NaCI B.HCl C. H2O D. NaOH
23.下列物质的酸性最强的是
A.H2CO3 B.H2SO4 C.H3PO4 D.H2SiO3
24.铀元素的核电荷数为92它有三种同位素234U 235U 238U,它们原子中所含的中子数为
A.234,235,238 B.142,143,146 C.326,327,330 D.92,92,92
25.将燃烧的镁条插入下列气体中,不能继续燃烧的是
A.氧气 B.氮气 C.二氧化碳 D.氩气
26.在NO2与水反应中,发生还原反应和氧化反应的物质,其质量比为
A.3:1 B.1:3 C.1:2 D.2:1
27.能用NaOH溶液进行喷泉实验的一组气体是
A.HCl,CO2 B.NH3,N2 C.SO2,CO D.NO,NO2
28.硝酸的酸酐是
A.NO B.NO2 C.N2O3 D.N2O5
29.在稀硝酸中能大量共存的离子组是
A.Ag+,Cl-- B.Na+,S2-- C.NH4+,SO42-- D.K+,SO32—
30.在NO2与水反应中,NO2的作用是
A. 氧化剂 B.还原剂 C.既是氧化剂又是还原剂
D.不是氧化剂也不是还原剂
二、填空题(20分)
31.A、B、C、D是4种短周期的元素,它们的原子序数依次增大,其中A、C及B、D分别是同主族元素,又知B、D两元素的原子核内质子数之和是A、C两元素的原子核内质子数之和的2倍,这四种元素的单质中有2种是气体、2种固体。并且B元素是地壳中含量
居第一位的非金属元素。写出元素符号:A__B__C_ D__
32.硼在自然界里有两种同位素10B和11B,已知硼的近似原子量为10.81,由此可推算出天然硼原子中10B占___%
33.原子序数为16的元素位于周期表中的____周期___族,它属于___________元素(填类别)
34.白磷和红磷互为_______体,其中______有剧毒。
35.在下图所示的装置的烧瓶里装满哪些气体,经过正确的操作,能看到美丽的喷泉___________(1分)
36.配平下列化学方程式(4分)
(1)囗 Mg+囗 HNO3(稀)――囗Mg(NO3)2+囗NH4NO3+囗H2O
(2)囗K2S+囗HNO3——囗KNO3+囗S+囗NO+囗H2O
37.用电子式表示
(1) MgF2离子键的形成过程______ (2 ) CO2分子________
38.写出2种含有极性键的非极性分子的化学式________
39.构成分子晶体的微粒之间是通过____互相结合在一起的,常见的分子晶体有____
三、简答题(4分)
40.用在量筒收集一筒二氧化氮气体,倒扣在盛水的水槽里。一会儿看到量筒里红棕色气体消失,量筒里水面上升到量筒容积的2/3,再往量筒里通入适量的氧气,又出现红棕色,一会儿红棕色又消失,水面又上升,这是什么原因?写出反应的化学方程式
四、推断题(6分)
41.室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下面框图进行反应。又知E溶液是无色的,请回答;
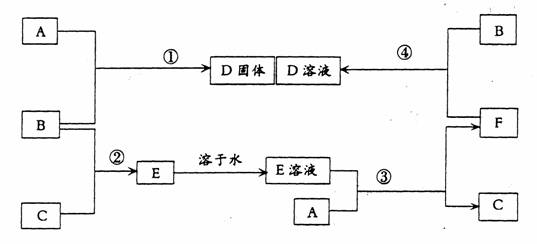
(1)A是__________B是_________C是____________(请填化学式)
(2)反应①的化学方程式为:________________________________。
(3)反应③的化学方程式为:_______________________________
(4)反应④的化学方程式为:________________________________。
六、计算题(10)
42取一根镁条置于坩埚内点燃,得到氧化镁和氮化镁混合物的总质量为0.470g冷却后加入足量水,将反应产物加热蒸于并灼烧,得到的氧化镁质量为0.486g (1)写出氮化镁与水反应生成氢氧化镁和氨的化学方程式。(2)计算燃烧所得混合物中氮化镁的质量分数。
43.取由铜银金组成的合金戒指样品1g,放入足量硝酸中充分溶解后,加入足量的盐酸,过滤、烘干得白色沉淀0.287g,在滤液中加入氢氧化钠溶液直到溶液呈强碱性,过滤、凉干得蓝色沉淀0.196g,求合金戒子的含金量?