一、 选择题(每小题有一个或两个正确选项符合题意)
1、 某固体仅由一种元素组成,其密度为5g ·cm— 3。用X射线研究该物体的结果表明:在棱长为1×10—7cm的立方体中含有20个原子,则此元素的原子量最接近
A、32 B、65 C、120 D、150
2、 若某氖原子的质量是a g ,12C的原子质量是b g ,NA表示阿伏加德罗常数,下列说法正确的是
A、氖原子的原子量是12 a / b B、该氖原子的摩尔质量是a·NA·g
C、Wg该氖原子的物质的量是W / (a·NA)mol D、Wg该氖原子所含质子数为10W/a
3、 依照阿伏加德罗定律,下列叙述正确的是
A、同温同压下两种气体的体积之比等于摩尔质量之比
B、同温同压下两种气体的物质的量之比等于密度之比
C、同温同压下两种气体摩尔质量之比等于密度之比
D、同温同压下两种气体的物质的量之比等于压强之比
4、 下列说法正确的是:(NA表示阿伏加德罗常数)
A、标准状况下,以任意比混合的甲烷和丙烷混合物22.4L,含有的分子数为NA
B、标准状况下,1L辛烷完全燃烧,所产生的气体产物的分子数为8/22.4NA
C、常温常压下,活泼金属从盐酸中置换出1mol H2,发生的电子转移数目为2NA
D、常温常压下,1mol氦气含有核外电子数为4NA
5、 某物质A在一定条件下加热分解,产物都是气体,分解方程式为2A = B+2C+2D,
测得生成的混合气体对氢气的相对密度为d,则A的式量为
A、7d B、5d C、2 .5d D、 2d
6、 由二氧化碳、氢气和一氧化碳组成的混合气体在同温同压下与氮气的密度相同。则该混合气体中二氧化碳、氢气和一氧化碳的体积比为:
A、29:8:13 B、22:1:14 C、13:8:29 D、26:16:57
7、 在化合物X2Y和YZ2中,Y的质量分数分别约为40%和50%,则在化合物X2YZ3中Y的质量分数约为
A、20% B、25% C、30% D、35%
8、 在反应X + 2Y = R + 2M中,已知R和M的摩尔质量之比为22:9,当1.6gX与Y完全反应后,生成4.4g R,则在此反应中Y和M的质量之比为:
A、16:9 B、23:9 C、32:9 D、46:9
二、填空题
9、 碳原子12C(下同)的相对原子质量为________,一个碳原子的质量是______,
1mol碳原子的质量是_________,碳的摩尔质量为__________。
10、 在常温下,对A和B两种物质组成的混合气体(A的式量大于B)进行分析,知混合气体中有氮和氧,而且不论A、B以何种比例混合,氮和氧的质量比总大于7:8,小于7:4,由此可确定A为___________,B为___________(写化学式)。若上述气体中氮和氧质量比为21:20,则混合气体中A和B的物质的量之比为___________。
11、 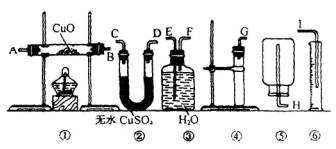 现有药品:Wg(W<1)锌片、无水硫酸铜、氧化铜和水。请从图中选用适当的实验装置,设计一个简单的实验,粗略测定锌的原子量(假使环境为标准状况)。
现有药品:Wg(W<1)锌片、无水硫酸铜、氧化铜和水。请从图中选用适当的实验装置,设计一个简单的实验,粗略测定锌的原子量(假使环境为标准状况)。
(1)应选用的装置是
__________(填写编号)
(2)所选用装置的接口的连接顺序(填写字母)
_________________________________________________
(3)为了保证不漏气,操作中加放试剂的方法是___________________________
_______________________________________________
(4) 用实验所测得的数据,写出计算锌的原子量的数学表达式:______________。
12、 Cl2通入浓氨水会发生反应:3Cl2 + 8NH3 = 6NH4Cl + N2。今有体积为1.12L,质量为3.335g的氯气和氮气的混合气体,将该气体通过浓氨水,体积变为0.672L(其中氯气和氮气各占50%)。(气体体积均在标准状况下测得)
(1)经计算,被氧化的氨的质量为____________ 克。
(2)下面是甲、乙、丙三位同学从不同的角度解这道题是所列的第一步算式,请判断他们所列的未知数x分别表示什么量,并填空。
|
编号 |
所列第一步算式 |
X表示的意义 |
|
甲 |
(3—1) :2 = [(1.12—0.672)÷22.4] :x |
① |
|
乙 |
3(x—0.672÷2) = 1:[0.672÷2—(1.12—x)] |
② |
|
丙 |
71x + 28(1—x ) = 3.335×22.4÷11.2 |
③ |
①
②
③