| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。 有关反应的化学方程式 、 劣质不锈钢腐蚀的实验现象: 。 四、推断题(本题1小题,共10分) 17.(10分)已知A、B、C为常见的单质,在一定条件下相互转化的关系如图:(有部分物质省略)
(1)若常温下,A、B均为气体,C为红色固体,E为黑色固体,则E的化学式为_____,写出A E→D的化学反应方程式___________________________________________。 (2)若常温下B、C均为气体,A为金属单质,D为黑色晶体,则E的电子式为______ ,写出A E→D的化学反应方程式 ______________________________________________。 (3)若常温下B为气体,C为黑色固体,则金属A的原子结构示意图为_____ _ ,写出A E→D的化学反应方程式____________________________________________。 五、填空题(本题包括3小题、共33分)
SiO2 + C+ N2 Si3N4 + CO (1)配平上述反应的化学方程式(将化学计量数填在方框内); (2)该反应的氧化剂是 ,其还原产物是 ; (3)该反应的平衡常数表达式为K= ; (4)若知上述反应为放热反应,则其反应热△H 零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”); (5)若使压强增大,则上述平衡向 反应方向移动(填“正”或“逆”); (6)若已知CO生成速率为v(CO)=18mol/(L.min), 则N2消耗速速率为v(N2)= mol/(L.min)。 19.
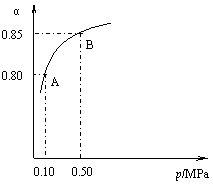 (11分)二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。 (11分)二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化成SO3: 2SO2(g)+O2(g) 某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示。根据图示回答下列问题: ① 将2.0 mol SO2和1.0 mol O2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。该反应的平衡常数等于 。 ② 平衡状态由A变到B时,平衡常数 K(A) K(B)(填“>”、“<”或“=”)。 (2)用CH4催化还原NOx可以消除氮氧化物的污染。例如: CH4(g) 4NO2(g) CH4(g) 4NO(g) 若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为 阿伏伽德罗常数用NA表示),放出的热量为 kJ。 (3)新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=MN、CO、ZN或NI)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
请写出MFe2Ox分解SO2的化学方程式 (不必配平)。
 “减小”或“不变’’)。 “减小”或“不变’’)。
②不同温度、压强下,合成 氨平衡体系中NH3的物质的 量分数见下表(N2和H2的 起始物质的量之比为1:3). 分析表中数据, ℃ MPa时H2转化率最高,实际工业生产不选用该条件的主要原因是 。 ③下列关于合成氨说法正确是 。(填字母) A.使用催化剂可以提高NH3的产率 B.寻找常温下的合适催化剂是未来研究的方向 C.由于ΔH<0,ΔS>O故合成氨反应一定能自发进行 (2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。它既有液氢燃料电池的优点,又克服了液氢不易保存的不足。其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气。其电池反应为4NH3 302=2N2 6H20。你认为电解质溶液应显 性(填“酸性”、“中性"、“碱性”), 其原因是 ,写出负极电极反应式 。 六、计算题(本题包括1小题,共8分。) 21.(9分)将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示: (1)写出OA段所发生反应的离子方程式____ _______________________________。 (2)当加入35mL盐酸时,产生CO2的体积为___________mL(标准状况)。 (3)计算原混合物中NaOH的质量及碳酸钠的质量分数。
第七次双周练化学试卷(答题纸) 第Ⅰ卷(选择题)
| 题号
| 1
| 2
| 3
| 4
| 5
| 6
| 7
| 8
| 答案
|
|
|
|
|
|
|
|
| 题号
| 9
| 10
| 11
| 12
| 13
| 14
|
|
| 答案
|
|
|
|
|
|
|
| | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
第Ⅱ卷(非选择题)
三、实验题(本题包括2小题,共21分)
15.
16(1)
(2)
(3)
(4) 、
四、推断题(本题1小题,共10分)
17(1)
(2)
(3)
五、填空题(本题包括3小题、共33分)
18(1)配平上述反应的化学方程式(将化学计量数填在方框内);
SiO2 + C+ N2 = Si3N4 + CO
(2) 、
(3)
(4) 、
(5)
(6)
19. (1)① ②
(2)
(3)
20(1)① ②
③
(2)
六、计算题(本题包括1小题,共8分。)
(1)
(2)
(3)
1--14选择题答案为红色部分
15.ACD
16.(1)2Fe3 +Cu=2Fe2 +Cu2
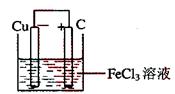 (2)装置图
(2)装置图
正极反应:Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+)
负极反应:Cu=Cu2++2e-(或Cu-2e-=Cu2+)
(3)①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液的pH至3.2~4.7;
③过滤[除去Fe(OH)3]
(4)CuO+H2SO4=CuSO4+H2O
CuSO4+Fe=FeSO4+Cu,不锈钢表面有紫红色物质生成。
17.(10分)(1) E:CuO,(2分)H2 CuO ![]() \* MERGEFORMAT Cu H2O。 (2分)
\* MERGEFORMAT Cu H2O。 (2分)
(2) E: ![]() \* MERGEFORMAT (1分),3Fe 4H2O(g)
\* MERGEFORMAT (1分),3Fe 4H2O(g) ![]() \* MERGEFORMAT Fe3O4 4H2。 (2分)
\* MERGEFORMAT Fe3O4 4H2。 (2分)
(3) A: 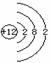 (1分),2Mg CO2
(1分),2Mg CO2 ![]() \* MERGEFORMAT 2MgO C。(2分)
\* MERGEFORMAT 2MgO C。(2分)
18.答案:(1)3,6,2,1,6
![]() (2)N2,Si3N4
(2)N2,Si3N4
(4)小于;减小
(5)逆
(6)6
19.(1)①800L·mol-1 ② = (2)1.60NA,173.4
(3)MFe2Ox+SO2→MFe2O4+S
20.(1)① 减小②200 100 ③B
(2)碱性 2NH3-6e 6OH-=N2 3H2O
21.(1) H OH-=H2O H CO32-=HCO3-
(2)224
(3) 0.6 42.4
| |