一、 选择题(每题仅有一个正确答案,每题1分,共5分)
1.下列物质的水溶液中,除水分子外,不存在其它分子的是 [ ]
A.KF B.NaHS C.H3PO4 D.HNO3
2.对于相同体积的K2CO3溶液(浓度为M1)和(NH4)2CO3溶液(浓度为M2),若其中CO32-的物质的量浓渡相同,则它们物质的量浓度M1和M2的关系是 [ ]
A.M1<M2 B.M1>M2 C.M1=M2 D.M1=2M2
3.钢铁表面吸附了中性水膜发生电化腐蚀.这时①铁作正极被氧化,②铁作负极被氧化,③水膜中有气体析出.④空气中某成分气体被还原.其中正确的是 [ ]
A.①③ B.②④ C.②③ D.①④
4.为了使纯锌与0.05mol/L、20mL稀硫酸反应速率加快,可以采取的措施是 [ ]
A.加入2mL 0.1mol/L的盐酸
B.加入2mL 0.1mol/L的硫酸铜溶液
C.加入2mL 0.1mol/L的氯化钡溶液
D.加入2mL 0.1mol/L的氨水
5.pH相同的醋酸溶液和盐酸,分别用蒸馏水稀释到原溶液的m倍和n倍,稀释后两溶液的pH仍相同,则m和n的关系量是 [ ]
A.m=n B.m>n C.m<n D.无法判断
6.用铅蓄电池作电源时,正极材料是PbO2,负极材料是Pb,其放电过程可以表示为:Pb+PbO2+2H2SO4=2PbSO4+2H2O充电时发生还原反应的电极方程式为 [ ]
A. Pb-2e=Pb2+
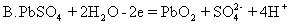
C、bO2+4H++2e =Pb2++2H2O
D.PbSO4+2e =Pb+SO42-
7.下列物质的分类组合全部正确的是 [ ] 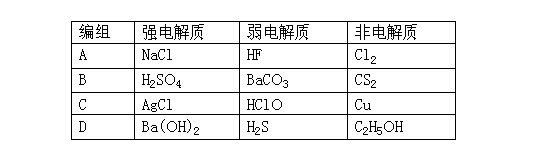
8.要使0.1mol/L CH3COOH溶液中CH3COOH的电离度和pH都减小,同时又使CH3COO-浓度增大;可加入的试剂是 [ ]
A.CH3COONa晶体 B.氨水
C.1mol/L H2SO4溶液 D.1mol/L CH3COOH溶液
9.在下列情况下,溶液的pH减小的是 [ ]
A. NaOH浓溶液加水稀释
B. Zn、Cu和稀H2SO4组成的原电池放电
C. 用Pt电极电解KCl的水溶液
D.FeCl3浓溶液滴入沸水中
10.FeCl3溶液与Fe(OH)3胶体共同具备的性质是 [ ]
A. 分散质的微粒都可通过滤纸
B. 都比较稳定,密封一段时间也不会产生沉淀
C. 有丁达尔现象
D.加入盐酸先产生沉淀,后沉淀溶解
11.25℃时,0.1mol/L一元弱酸溶液,达到电离平衡时,溶质分子与溶质离子的个数比为11.3:1,在该溶液中一元弱酸的电离度是 [ ]
A.4.24% B.4.07% C.4.42% D.8.84%
12.pH与体积都相同的硫酸和醋酸溶液,分别与同物质的量浓度、同体积的Na2CO3溶液反应,在相同条件下,放出CO2的量也相同,则可能是 [ ]
A. Na2CO3过量
B. Na2CO3的量恰好与醋酸完全反应
C. Na2CO3的量恰好与硫酸完全反应
D.两种酸都过量
13.下列叙述正确的是 [ ]
A. 强酸跟盐反应一定得到弱酸
B. 把pH=6与pH=8的两种强电解质溶液等体积混合,其pH不一定为7
C. 室温时同浓度的Na2CO3溶液的pH大于60℃时它的pH
D.同浓度的钾盐溶液其酸式盐的pH一定小于正盐的pH
14.浓度均为0.1mol/L的四种一元酸:Ha、Hb、Hc、Hd,已知Ha的[H+]为0.01mol/L,Hb的电离度为0.1%,Hc的pH为3,Hd的[OH-]=1×10-13mol/L.它们的四种钾盐在物质的量浓度相同的溶液中,其pH大小顺序正确的是 [ ]
A.Ha>Hb>Hc>Hd B.Hd>Hc>Hb>Ha
C.Hc>Hb>Hd>Ha D.Hb>Hc>Ha>Hd
15.把pH=3的盐酸和pH=10的Ba(OH)2溶液混合,若混合溶液的pH为7,则盐酸和Ba(OH)2溶液的体积比是
[ ]
A.1:10 B.1:5 C.1:2 D.2:1
16.某氨水的pH=x,某盐酸的pH=y,x+y=14,且x>11,将上述氨水和盐酸等体积混合后,所得溶液中各种离子的浓度由大到小的顺序为 [ ]
A.[Cl-]>[NH4+]>[H+]>[OH-]
B.[NH4+]>[Cl-]>[OH-]>[H+]
C.[Cl-]>[NH4+]>[OH-]>[H+]
D.[NH4+]>[Cl-]>[H+]>[OH-]
17.足量镁粉与一定量的稀硫酸反应,由于反应速率太快,为了减慢反应速率,又不影响H2的产量,可以加入下列物质中的 [ ]
A.MgO B.NaOH C.K2CO3 D.CH3COOK
18.下列操作会引起实验误差的是 [ ]
A.进行中和滴定时,直接向刚洗净的锥形瓶中加待测液
B.滴定未知浓度盐酸所用的0.05mol/LNaOH溶液, 在配制标准液时因与空气接触吸收了少量的CO2
C.用标准NaOH溶液滴定未知浓度的稀H2SO4时,用酚酞作指示剂
D.往洗净的滴定管中,直接加入标准液.
19.用铂电极电解CuSO4溶液,在阳极收集到0.4gO2,中和电解时生成的酸用去250mLNaOH溶液,则此NaOH溶液物质的量浓度是 [ ]
A.0.20mol/L B.0.15mol/L
C.0.10mol/L D.0.05mol/L
20.用阳极甲、阴极乙、电解质溶液丙,在电解过程中补充加入丁物质(纯),可以使电解液的组成保持恒定.下列答案正确的是 [ ]
甲 乙 丙 丁
A.Pt Pt KOH KOH
B.Cu Fe CuSO4 CuSO4
C.Pt C H2SO4 H2O
D.C Fe NaCl NaCl
三、 填空题(共35分)
21.下列微粒中:①Na+ ②ClO- ③NH4+ ④HSO4- ⑤HCO3- ⑥HS-⑦CO32- ⑧Cl-(按序号填空)
A.既能参与电离平衡,又能参与水解平衡的是 ,
B.既不能参与电离平衡,又不能参与水解平衡的是 ,
C.只能参与水解平衡的是 .
22.下列各物质的溶液物质的量浓度均为0.1mol/L.
①HCOOH ②NaOH ③Na2CO3 ④CH3COONa
⑤NH4Cl ⑥Ba(OH)2 ⑦KCl ⑧CH3COOH
按它们pH由小到大的排列顺序为 .
23.用铂电极电解KI溶液时,其电极反应表示为:阴极 ;阳极 ;电解总的化学方程式为 .
24.用铂电极电解K2SO4溶液时,其电极反应表示为:阴极 ;阳极 ,电解总的化学方程式为 .
25.用铜电极电解K2SO4溶液;通电开始时,其电极反应表示为:阴极 ;阳极 .向阴极溶液中滴入酚酞,则显 色,原因是 ;阳极附近的溶液出现 色,原因是 .
26.中和某一强酸溶液,需要一定量的KOH,用“>”、“<”、“=”填空:
A.如改用和上述KOH质量相同的Na2CO3反应,
反应后溶液的pH 7,
B.如改用和上述KOH物质的量相同的氨水反应,
反应后溶液的pH 7,
C.如改用和上述KOH质量相同的Ba(OH)2反应,
反应后溶液的pH 7.
27.氯化铁水解的离子方程式为 ,向氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,并产生无色气体,其离子方程式为 .同时有红褐色沉淀生成,其原因是 .
28.电子表和电子计算器常用微型银-锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,电极反应分别为:
Zn+2OH--2e =ZnO+H2O Ag2O+H2O+2e =2Ag+2OH-
总的化学方程式为: .
根据上述变化判断:正极为 ,负极为 ,工作时电极 极附近溶液的pH减小.
四、 计算题(共15分)
29.当电流通过2L KOH溶液(?=1.05g/mL)时,其质量分数由原来的6%变为8%,这时阳极生成什么物质?质量为多少克?