| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
10. 要求设计实验证实,某种盐的水解是吸热的,有四位学生分别作出如下回答,其中正确的是 A. 甲学生:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的 B. 乙学生:在盐酸中加入相同温度的氨水,若实验过程中混合液温度下降,说明盐类水解是吸热的 C. 丙学生:在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明盐类水解是吸热的 D. 丁学生:在醋酸钠溶液中滴入酚酞试液,加热后若红色加深,说明盐类水解是吸热的 11. NA表示阿伏加德罗常数的值,下列说法不正确的是 A.将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积为22.4 L B.14 g氮气中所含的共用电子对数为1.5NA C.1 L 1 mol·L-1 FeCl3溶液中,含Fe3 的个数少于NA D.合成氨反应中,当断裂3NA个H—H共价键的同时生成6NA个N—H共价键,则该反应达到平衡 12.实验室进行NaCl溶液蒸发时,一般有以下操作过程:①固定铁圈位置;②放置酒精灯;③放上蒸发皿;④加热搅拌;⑤停止加热、余热蒸干。其正确操作的顺序是( ) A.②①③④⑤ B.①②③④⑤ C.②③①④⑤ D.②③①④⑤ 13.下列保存试剂的方法中,错误的是 ( ) A.氢氟酸要保存在塑料瓶中 B.新制的氯水要保存在无色细口瓶中,并放置在光亮处 C.少量液溴要保存在棕色细口橡皮塞瓶中,并在液溴面上加水封 D.单质碘要保存在棕色广口瓶中,并放置在阴凉处 14.氰气的化学式为(CN)2,它的性质和卤素相似,称为拟卤素,对其性质和有关化合物性质的叙述不正确的是 ( ) A.NaCN 和AgCN都易溶于水 B.HCN不易形成白雾 C.MnO2可与HCN反应生成(CN)2 D.(CN)2和NaOH溶液反应生成NaCN、NaCNO 和H2O 15.浓盐酸和次氯酸钙能发生如下反应Ca(ClO)2 4HCl(浓)=CaCl2 Cl2↑ 2H2O,用贮存较久的的漂粉精与浓盐酸反应制得的氯气中,可能含有的杂质为 ( ) A.CO2 、HCl 、H2O (g) 三种 B.HCl 、H2O、O2三种 C.只有HCl和H2O(g)二种 D.只有CO2和O2二种 16.已知H2 F2=2HF,2F2 2H2O=4HF O2,HF NaOH=NaF十H2O,现若将aLH2和F2的混合气体在暗处发生爆炸性化合反应用足量的NaOH溶液吸收铅制密闭容器中的气体,最后残余同条件下的气体bL,原混合和气体中F2的体积可能是 ( ) A.(a b)/2L B.(a-b)/2L C.(2a b)/2L D.(a-2b)/2L 三 、实验题,本题包括3小题,共 分 17.(9分)实验室配制250mL 0.5mol·L-1的Na2CO3溶液,有如下操作步骤:①将称量好的Na2CO3固体放入烧杯中,加入适量的蒸馏水溶解;②把①所得溶液小心转入250mL容量瓶中;③继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,小心滴加蒸馏水至溶液凹液面与刻度线相切;④用少量蒸馏水洗涤烧杯2~3次,每次洗涤的液体都小心转入容量瓶中并轻轻摇匀;⑤计算所需Na2CO3固体的质量并用托盘天平称取;⑥塞紧容量瓶的塞子,充分摇匀。回答下列问题: (1)本实验操作步骤的正确顺序是(填序号) ⑤ ① ② ④ ③ ⑥ 。 (2)本实验中除用到容量瓶和烧杯外,还需要用到的玻璃仪器有 胶头滴管、玻璃棒。 (3)实验中用托盘天平实际称取Na2CO3固体的质量是 13.3 g。 (4)在实验中,若出现如下情况,对所配溶液的浓度有何影响? 未进行操作④,所配溶液的浓度会 “偏低” (填“偏高”、“偏低”或“无影响”,下同);定容时俯视液面,所配溶液的浓度会 “偏高” 。 (5)若实验过程中出现如下情况应如何处理? 加蒸馏水时不慎超过了刻度: 重新配 ; 向容量瓶中转移溶液时,不慎有少量溶液液洒在容量瓶外面: 重新配 。 18(3分).回答下列问题(填序号): (1)下列仪器中:①漏斗 ②容量瓶 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥量筒 ⑦燃烧匙。常用于物质分离的是 ①③⑤ ,其中根据物质沸点不同分离物质的仪器是 ③ 。 (2)实验室有贮存以下物质的方法: A. 氯水不宜长期存放,若短期保存需避光;B. 浓硝酸用棕色瓶盛放,贮存在阴凉处。 C. 通常向盛有溴单质的试剂瓶中加入适量的水 D.金属钠常保存在煤油中; E.NaOH溶液通常用带玻璃塞的磨口试剂瓶保存; 其中正确的是 ABCD 19(8分).(1)有H2、O2、NO、NH3、NO2五种气体:其中与制取O2 的发生装置相同的是 NH3 (1分);请写出实验室制取该气体的方程式 2NH4Cl+Ca(OH)2 eq \o(\s\up8(△),══,\s\do4())△CaCl2+2NH3↑ 2H2O (2分) ;
 要得到干燥的该气体可选用 碱石灰(1分) 做干燥剂。只能用一种方法收集的是 NO、NH3、NO2 要得到干燥的该气体可选用 碱石灰(1分) 做干燥剂。只能用一种方法收集的是 NO、NH3、NO2
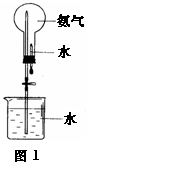
(2)用下图装置进行喷泉实验(图中夹持装置均已略去)。 上部烧瓶已装满干燥氨气,引发水上喷的操作是 打开止水夹,挤出胶头滴管中的水。(1分) ,该实验的原理 是 氨气极易溶解于水,致使烧瓶内气体压强迅速减小。 四、填空题本题包括3小题,共 分 20.在卤素单质中,与H2混合后在暗处就能发生剧烈爆炸的是______,与水剧烈反应并放出O2的是_____,不能将其它卤化物中的卤素置换出来的是______。 新制备的氯水显______色,说明氯水中有______分子存在。向氯水中滴入几滴AgNO3溶液,立即有_________生成,说明氯水中有______存在。蓝色石蕊试纸碰到氯水后,首先变红,但很快又褪色,这是因为________________________________。氯水经光照后,颜色逐渐消失,并放出无色的_____气,该反应的化学方程式为__________________。 F2;F2;I2;浅黄绿色;Cl2;白色沉淀;Cl-;因含H+故先变红,又因含HClO故又被漂白而褪色;
O2;2HClO=2HCl+O2↑ 21.(15分)A是某工厂废旧机械表面上红色固体的主要成分,B、C、F都是单质,D、F都是无色无味的气体,它们之间的相互转化关系如下图:
请回答: (1)写出下列物质的化学式: C____________,F___________,B__________,G的溶质____________。 (2)写出图中气体D和澄清石灰水反应相应的化学方程式:_________________________________ 21.(1) C:Fe F:H2 B:C G:FeSO4 (2)CO2 Ca(OH)2==CaCO3↓ H2O 22.KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为
(1)请配平上述化学方程式(计量数填入框内) (2)浓盐酸在反应中显示出来的性质是___________(填编号) ①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性 (3)产生0.1mol Cl2,则转移的电子的物质的量为________mol。 (1)2,4=2,2,1,2; (2)②; (3)0.2。 四、计算题(本大题包括2小题,共23分) 23.向密度为1.45g·cm-3的硫酸溶液逐滴加入BaCl2溶液,直到反应完全为止,生成沉淀的质量与原硫酸溶液的质量相等,则硫酸溶液中溶质的质量分数为________,物质的量的浓度为___________。 24、42.1%;6.22mol·L-1 24.(8 分)有两份溶液,其中所含溶质相同,设其摩尔质量为Mg/mol。根据下表信息,回答有关问题:
|
| 溶质的质量分数
| 溶液的密度(g·cm-3)
| 第一份溶液
| ω1
| ρ1
| 第二份溶液
| ω2
| ρ2 |
⑴第一份溶液中,溶质的物质的量浓度为 。
⑵取等质量两份溶液混合,则所得混合液中溶质的质量分数ω3= 。
⑶若有ω1>ω2,取等体积的两份溶液混合,设所得混合液中溶质的质量分数为ω4,试比较ω3、ω4的相对大小?① ② 。
24.⑴ ![]() mol/L …………………………………………………(2分)
mol/L …………………………………………………(2分)
⑵ ![]() ……………………………………………………………(2分)
……………………………………………………………(2分)
⑶ ①若ρ1>ρ2,ω4>ω3;②若ρ1<ρ2,ω3>ω4……………………(4分)
| |