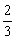原子量:H 1 O 16 C 12 He 4 Li 7 Na 23 K 39 Rb 85.5 S 32
一、选择题(每小题有1 2个正确选项)
1下列属于同位素的一组是
A水和重水 BNa2O和Na2O2
C氕、氘、氚 D40K、40Ca
2科学家最近研制出核电荷数为112的新元素,其原子的质量数为277,下列关于该新元素的叙述中正确的是
A其原子核内质子数和中子数均为112
B其原子核内中子数为165,核外电子总数为112
C其原子的质量是12C原子质量的277倍
D其原子质量与12C原子质量之比为277∶12
3等物质的量的氢气和氦气在同温同压下具有相同的
A原子数 B体积 C质子数 D质量
4设某元素的某原子核内质子数为m,中子数为n,则下述论断中正确的是
A不能确定该元素的原子量
B这种元素的原子量为(m + n)
C若碳原子的质量为w克,此原子的质量为(m + n)w克
D核内中子的总质量小于质子的总质量
5在盛有氢氧化钠溶液的试剂瓶口,常看到白色固体生成,该固体是
A NaOH B Na2O C NaHCO3 D Na2CO3
6下列属于钾离子性质的是
A极易被氧化 B有银白色金属光泽
C能置换出CaCl2中的Ca D焰色反应为浅紫色
7某碱金属0.195克与足量水反应,生成0.005克氢气,则此金属为
A Li B Na C K D Rb
8除去苏打中混有的小苏打的方法是
A水洗 B加热 C通入CO2 D加入盐酸
9将CO2通入下列溶液中,不可能产生沉淀的是
A CaCl2溶液 B 石灰水
C饱和碳酸钠溶液 D Ba(OH)2溶液
10 关于锂的结构和性质判断错误的是
①与水反应比钠剧烈,②原子半径小于钠,③它的氧化物在空气中易吸收二氧化碳,④它的阳离子最外层电子数与钠的阳离子相同,⑤它是还原剂
A①④ B②③ C③⑤ D只有①
11把a克Na2O和a1克Na2O2分别加入等质量的水中(水足量),得到相同浓度的溶液,则A与A1正确的关系是
Aa = a1 Ba > a1 Ca < a1 D无法判断
12用1升1.0mol / L的NaOH溶液吸收0.8 mol CO2,所得溶液中CO32-与HCO3-的物质的量浓度之比为
A1∶ 3 B2∶ 1 C2∶ 3 D3∶ 2
13下列离子方程式中正确的是
A水中加入金属钠 Na + 2H2O = Na+ + 2OH- + H2
B碳酸氢钙溶液中加入盐酸 CO32- + 2H+ = H2O + CO2
C氢氧化铜中加入盐酸 OH- + H+ = H2O
D稀硫酸与氢氧化钡溶液混合 2H+ + SO42-+ Ba2+ + 2OH- = 2H2O + BaSO4 ¯
14下列各组离子能够在同一溶液中共存的是
A.HCO3- 、OH- 、Na+、K+ B.S2-、Cu2+、Cl- 、SO42-
C.SO42- 、Mg2+、Ba2+、OH- D.Na+、K+、Cl- 、NO3-
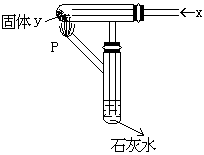 15如右图所示,持续通入X气体,并在管口P处点燃,实验结果使澄清石灰水,变浑浊,则X、Y可能是
15如右图所示,持续通入X气体,并在管口P处点燃,实验结果使澄清石灰水,变浑浊,则X、Y可能是
A.H2和NaHCO3
B.CO和Na2CO3
C.CO和CuO
D.H2和Fe2O3
16硼有两种天然同位素10B和11B,硼元素的相对原子质量为10.8,则对10B的质量分数判断正确的是
A.20% B. 略大于20% C.略小于20% D.80%
17某混合气体,可能含有N2、HCl、CO。把混合气体依次通过足量的NaHCO3溶液和灼热的氧化铜,气体体积均无变化。再通过足量的Na2O2固体,气体体积减小。最后通过灼热的铜网,经充分反应后气体体积又减小,但仍有剩余。对下列混合气体组成的判断中,正确的是
A一定没有N2,CO和HCl中至少有一种
B一定有N2,HCl和CO
C一定有N2,CO和HCl中至少有一种
D一定有N2和HCl,没有CO
18下列各组物质按照碱性递减顺序排列的是
A.LiOH、NaOH、CsOH B.Ba(OH)2、Ca(OH)2、Mg(OH)2
C.Ca(OH)2、KOH、Ba(OH)2 D.Al(OH)3、Mg(OH)2、NaOH
19下列各组微粒,具有相同电子数的是
A.K+和Br- B.Na+和F- C.H2O和NH3 D.OH-和F
20下列微粒中半径最大的是
A.S B.S2- C.Cl- D.K+
21在短周期元素中,属于非金属元素的有
A9种 B10种 C12种 D13种
22X元素的最高价氧化物对应的水化物化学式为H2XO3,则它对应的气态氢化物的化学式为
AHX BH2X CXH3 DXH4
23下列化合物中,既有离子键,又有共价键的是
ANa2O2 BNH3 CNH4Cl DHCl
24下列叙述正确的是
A分子是由一定数目的原子组成的,原子之间的相互作用叫化学键
B阴、阳离子通过静电吸引形成的化学键叫离子键
C非金属元素之间构成的化合物都不是离子化合物
D离子化合物中一定含有离子键
25甲、乙是同周期的非金属元素,若原子半径甲大于乙,则下列四种叙述中正确的是
A最高价氧化物的水化物酸性甲比乙强
B气态氢化物的稳定性甲比乙弱
C阴离子的还原性甲比乙弱
D金属性甲比乙弱
26下列离子化合物中,阳离了半径与阴离子半径之比最小的是
ANaF BLiI CCsF DLiF
27氢化钠(NaH)是一种白色的离子化合物,其中钠元素为+1价,NaH与水反应生成氢气,下列叙述正确的是
ANaH在水中显酸性 BNaH中氢离子电子排布与氦原子相同
CNaH中氢离子半径比锂离子大 DNaH中氢离子可以被还原成氢气
28A、B、C三种短周期元素,最高正价依次为+1、+2、+7,它们形成的双原子共价化合物的种类最多有
A1种 B2种 C3种 D多于3种
29关于周期表和周期律,下列说法中正确的是
A在周期表中,元素的族序数都等于其原子的最外层电子数
B周期表中非金属性最强的元素,其最高价氧化物的水化物酸性也最强
C同主族元素随原子核电荷数的递增,原子半径依次增大
DVIIA组元素的单质,随分子量的增大,熔、沸点升高;IA族单质,由上至下,随原子量递增,熔、沸点下降
30M元素的一个原子失去两个电子,转移到Y元素的两个原子,形成离子化合物Z,下列关于Z的说法中不正确的是
AZ的熔点较高 BZ可以表示为M2Y
CZ一定溶于水 DM形成+2价阳离子
31在常温下,下列化学式中能表示物质分子的实际组成的是
ANH4Cl BSiO2 CP4 DNa2O2
32三氯化氮(NCl3)常温下是一种淡黄色液体,其分子为三角锥形,下列叙述中正确的是
A分子中N Cl键是一种非极性键
B分子中N Cl键键能大,因此它的熔、沸点高
 C它的N原子能以配位键与氢离子结合
C它的N原子能以配位键与氢离子结合
D它的分子是由极性键构成的非极性分子
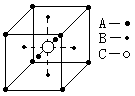
33某物质的晶体中含A、B、C三种元素,其排列方式如图所示晶体中A、B、C三种原子的个数比为
A.1∶ 3∶ 1 B.2∶ 3∶1
C.2∶ 2∶ 1 D.1∶ 3∶ 3
北京五中1999-2000学年度第二学期期中考试试卷
高一年级化学
二、填空题:
34将二氧化碳通入烧碱溶液中,可能发生的反应方程式为 、 ,上述反应若用离子方程式表示分别为 、 。
35有四种化合物,它们的焰色反应均为紫色,它们按下列反应转化:
①X + Ca(OH)2 → Y + CaCO3 ¯ ②W → X + CO2 + H2O
③Z + CO2 → X + O2 ④Z + H2O → Y + O2
上述四个反应,是离子反应的写离子方程式,不是离子反应的写化学方程式。
① ,② 。
③ ,④ 。
36(1)2.3克金属钠放入97.8克水中,完全反应后,所得溶液中,溶质的质量分数为 。
(2)2.3克金属钠放入M克重水(D2O)中,完全反应后,所得溶液中,溶质的质量分数为 。(用含M的代数式表示)
37X和Y两种元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素的阳离子半径,Z和Y两种元素原子核外电子层数相同,Z元素原子半径小于Y元素原子半径,X、Y、Z原子序数从大到小的顺序是 。
38有X、Y、Z三种短周期元素,X的气态氢化物化学式为H2X,此氢化物的式量与X最最高价氧化物的式量之比为17∶ 40,X原子核内质子数与中子数相等,Y与X可以形成离子化合物Y2X,Y的阳离子电子层结构与Ne相同,乙与X同周期,其气态单质是双原子分子,两原子共用1对电子。试回答:
(1)写出各元素符号:X 、Y 、Z 。
(2)X离子的结构简图为 。X与Y形成的离子化合物的电子式为 ,Z和氢形成的化合物的电子式为 。
(3)Y单质在空气中燃烧的化学方程式为 ,生成物与水反应的化学方程式为 。
39在元素周期表短周期中,最活泼的金属元素为 ,最活泼的非金属元素为 ,最外层电子数是次外层电子数2倍的元素是 ,最高价氧化物水化物酸性最强的酸是 ,电子总数为10的氢化物有 。
三、实验题:
40从下列A组物质中选择一种试剂,除去B组物质中的少量杂质,将正确答案的序号填入B组的括号内。
A组: (A)浓硫酸 (B)饱和石灰水 (C)氯水 (D)CO2(E)氯化钡溶液
B组:(1)碳酸氢钠溶液中混有碳酸钠()
(2)苛性钠溶液中混有碳酸钠( )
(3)硫酸钠溶液中混有亚硫酸钠( )
(4)氯化钾溶液中混有碘化钾( )
(5)氯化钾溶液中混有碘化钾( )
41填写下表:
|
实验步骤 |
化学方程式 |
离子方程式 |
|
①向AlCl3溶液中加入适量NaOH溶液 |
|
|
|
②向①的产物中再加入NaOH溶液 |
|
|
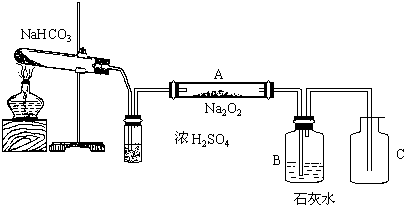
42根据如下装置回答问题:
(1)A中的现象是 。
(2)B中出现浑浊,写出反应的离子方程式 。
(3)C中收集的气体是 。
四、计算题:
43在标准状况下将4.48L CO2通过一定量的Na2O2后,收集到3.36L气体,
(1)判断3.36L气体的成分?
(2)计算3.36L气体的质量。
44将a mol Na2O2和b mol NaHCO3固体混合物在密闭容器中加热到250℃,让其充分反应(假设NaHCO3分解产生的CO2与Na2O2反应完后,H2O再与Na2O2反应)。
(1)当剩余固体为Na2CO3,排出气体为O2、H2O时, 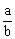 =
=
(2)当剩余固体为Na2CO3、NaOH,排出气体为O2、H2O时,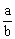 的取值范围是 。
的取值范围是 。
(3)当 >1时,剩余固体为 ,排出气体为 。
>1时,剩余固体为 ,排出气体为 。
(4)当排出的O2和H2O的物质的量相等时, 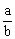 = 。
= 。
北京五中1999 2000学年度第二学期期中考试试卷
高一年级化学参考答案
一、选择题(每小题有1 2个正确选项)
|
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
|
答案 |
C |
BD |
BC |
A |
D |
D |
C |
B |
A |
A |
C |
A |
D |
D |
AC |
C |
C |
|
题号 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
31 |
32 |
33 |
|
|
答案 |
B |
BC |
B |
D |
D |
AC |
D |
B |
B |
BC |
C |
CD |
BC |
C |
C |
A |
|
二、填空题:
34CO2 + 2NaOH = Na2CO3 + H2O,CO2 + H2O + Na2CO3 = 2NaHCO3
CO2 + 2OH- = CO32- + H2O, CO2 + H2O + CO32- = 2HCO3-
35①Ca2+ + CO32- = CaCO3 ↓ ②2KHCO3 K2CO3 + H2O = CO2
K2CO3 + H2O = CO2
③2K2O2 + 2CO2 = 2K2CO3 + O2 ④2K2O2 + 2H2O = 4K+ + 4OH-+ O2
36.(1)4% (2)4.1÷(m+ 2.1)×100%
37.Z > Y > X
38.(1)S,Na,Cl
(2) ,Na+
,Na+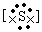 22-Na+,
22-Na+, 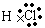
(3)2Na + O2 Na2O2,2Na2O2 + 2H2O = 4NaOH + O2
Na2O2,2Na2O2 + 2H2O = 4NaOH + O2
39.Na,F,C,HClO4;
CH4,NH3,H2O,HF
三、实验题:
40.B组:(1)(D) (2)(B) (3)(E)
(4)(A) (5)(C)
41.①AlCl3 + 3NaOH == Al (OH)3 ↓ + 3NaCl,Al3+ + 3OH- = Al(OH)3 ↓
②Al(OH)3 + NaOH = NaAlO2 + 2H2O,Al (OH)3 + OH- = AlO2- + 2H2O
42.(1)淡黄色固体变为白色。
(2)CO2 + Ca2+ + 2OH- = CaCO3 ↓ + H2O
(3)C装置中收集到O2
四、计算题
43.(1)3.36L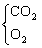 (2)6g
(2)6g
44(1)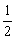 ,
,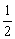 <
<  < 1
< 1
(2)Na2CO3,NaOH,Na2O2;O2
(3)