|
时量:90分钟 满分:108分 考生姓名_______ 计分________
本卷可能用到的相对原子质量:C:12 O:16 Fe:56 Al:27 Zn:65
一、选择题:(每小题只有一个选项正确,共54分)
1、固体融化时,必须破坏非极性共价键的是( )
A、冰 B、晶体硅 C、溴 D、二氧化硅
2、以下有关接触法制硫酸的论述,错误的是( )
A、为提高反应速率和原料利用率,硫铁矿要在“沸腾炉”状态下燃烧
B、为防止催化剂中毒,气体在进接触室前要先净化
C、接触室中热交换器的主要作用是预热未反应的气体和冷却反应后的气体
D、吸收塔中SO3从下而上,水从上而下,剩余气体从上部出来放空
3、铁棒和石墨用导线连接后,浸入0.01mol/L的食盐溶液中,可能出现的情况是( )
A、铁棒四周产生OH- B、铁棒被腐蚀 C、石墨上放出O2 D、石墨棒上放出Cl2
4、下列关于胶体的叙述,不正确的是( )
A、用渗析的方法净化胶体时,使用的半透膜只能让较小的分子、离子通过
B、一束光线通过气体时,胶体会形成一条“光亮”的通路
C、布朗运动是胶体粒子特有的运动方式,可以据此把胶体和溶液、悬浊液区别开来
D、胶体粒子具有较大的表面积,有的能吸附阳离子或阴离子而使胶体粒子带电荷,故在电场作用下会产生电泳现象
5、用惰性电极电解下列溶液一段时间后,阴极质量增加、溶液的PH明显下降的是( )
A、H2SO4 B、AgNO3 C、BaCl2 D、CuCl2
6、在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的是( )
A、滴加石蕊试液显红色的溶液:Fe3 、NH4 、Cl-、SCN-
B、PH为1的溶液:Cu2 、Na 、Mg2 、NO3-
C、水电离出来的C(H )=10-13mol/L:K 、HCO3-、Br-、Ba2
D、所含溶质为Na2SO4的溶液:K 、CO32-、NO3-、Al3
7、物质的氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关,下列各组物质由于浓度不同而能发生不同氧化还原反应的是( )
A、Zn和H2SO4 B、Cu和FeCl3溶液 C、CO2和NaOH溶液 D、Fe和HCl溶液
8、下列关于工业生产说法不正确的是( )
A、电解精炼铜时,用粗铜做阴极,纯铜做阳极
B、在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率
C、在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室
D、在侯式制碱工业中,向饱和氯化钠溶液中先通氨气,后通二氧化碳
 9、离子方程式NH4 2H2O H3O NH3·H2O所代表的是( ) 9、离子方程式NH4 2H2O H3O NH3·H2O所代表的是( )
A、氨水与盐酸反应 B、硫酸铵晶体溶于水
C、碳酸铵溶液与过量的盐酸溶液反应 D、氯化铵溶液与过量氢氧化钠溶液反应
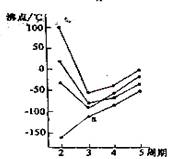 10、右图中每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是( ) 10、右图中每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是( )
A.H2S B.HCl C.PH3 D.SiH4
11、已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;
②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判定正确的是( )
A.上述实验证实氧化性:MnO4->Cl2>Fe3+>I2
B.上述实验中,共有两个氧化还原反应
C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝
D.实验②证实Fe2+既有氧化性又有还原性
12、强酸和强碱稀溶液的中和热可表示为:H (aq) OH-(aq)= H2O(l);△H=-57.3KJ/mol
已知:CH3COOH(aq) NaOH(aq)= CH3COONa(aq) H2O(l);△H1
1/2H2SO4(aq) NaOH(aq) = 1/2Na2SO4(aq) H2O(l);△H2
HNO3(aq) KOH(aq) =KNO3(aq) H2O(l);△H3
上述反应物除已注明的外均为稀溶液,则△H1、△H2、△H3的关系正确的是( )
A、△H1=△H2=△H3 B、△H1<△H2<△H3
C、△H2<△H3<△H1 D、△H2=△H1<△H3
13、下列叙述正确的是( )
A、NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B、CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
C、H2O是极性分子,分子中O原子不处在2个H原子所连成的直线的中心
D、CO2是非极性分子,分子中C原子不处在2个O原子所连成的直线中心
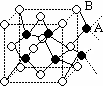 14、如图所示,离子晶体中每个阳离子A或阴离子B,均被另一种离子以四面体形式包围着,则该晶体对应的化学式为( ) 14、如图所示,离子晶体中每个阳离子A或阴离子B,均被另一种离子以四面体形式包围着,则该晶体对应的化学式为( )
A、AB B、A2B C、AB3 D、A2B3
15、下列说法正确的是( )
A、酯在一定条件下的水解产物一定是酸和醇
B、凡是含有醛基的物质都能发生银镜反应,但该物质不一定属于醛类
C、有机物3,3-二甲基-2-丁醇发生消去反应可生成两种烯烃
D、完全燃烧某有机物,生成CO2和H2O的物质的量之比为1 :1,该有机物一定是烯烃
16、实验室用浓盐酸与二氧化锰反应制氯气,下列有关说法中正确的是(气体体积在标况下测定)( )
A、若提供0.4molHCl,MnO2不足,则可得到氯气2.24L
B若提供0.4molHCl,MnO2足量,则可得到氯气2.24L
 C 若有0.4molHCl参与反应,则可制得氯气2.24L C 若有0.4molHCl参与反应,则可制得氯气2.24L
D若有0.4molHCl被氧化,则可制得氯气2.24L
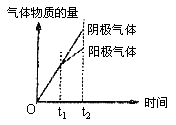
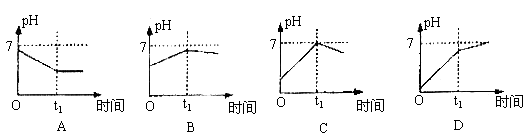 17、已知电解(石墨电极)盐酸、硫酸混合酸时两极生成的气体与时间关系如图所示,则其电解过程中溶液pH随时间变化关系正确的是( ) 17、已知电解(石墨电极)盐酸、硫酸混合酸时两极生成的气体与时间关系如图所示,则其电解过程中溶液pH随时间变化关系正确的是( )
18、在一接近中性的含Na 的澄清溶液中,可能还存在NH4 、Fe2 、I-、Br-、CO32-、SO32-六种离子中的几种。(1)在原溶液中滴加足量的饱和氯水后,有气泡产生;溶液呈橙黄色;(2)向呈橙黄色溶液中加入BCl2溶液时无沉淀生成;(3)橙黄色溶液不能使淀粉变蓝色。根据上述事实推断,该溶液中肯定不存在的离子组是( )
A、NH4 、Br-、CO32- B、Fe2 、I-、SO32- C、NH4 、Br-、SO32- D、Fe2 、I-、CO32-
二、非选择题(共54分)
19、请按要求填空:(6分)
(1)用______________(填仪器名称)量取16.50mL1mol/L的KOH溶液.
(2)用______________(填试剂名称)来洗涤做银镜反应后的试管。
(3)硫酸铜晶体结晶水含量的测定实验,包括研磨、加热、称量等操作步骤,其中判定硫酸铜晶体完全失水的定性实验现象是________________,完成测定实验过程至少要进行_________次称量操作。
20、(8分)要配制500mL0.2mol/L的FeSO4溶液,实验步骤有:①在天平上称取ag绿矾(FeSO4·7H2O),将它放在烧杯中,用适量蒸馏水使其完全溶解;②将所得溶液沿玻璃棒注入500mL容量瓶中;③继续向容量瓶中加水至液面距刻度线1-2cm处,改用胶头滴管加蒸馏水至液面凹面最低处与刻度线相平;④用少量水洗涤烧杯和玻璃棒2-3次,每次洗液都转入容量瓶;⑤将容量瓶塞紧,充分摇匀。填写下列空白:
(1)ag绿矾的实际质量是___________;
(2)上述操作步骤的正确顺序为_____________________;
(3)若配制时遗漏步骤④,会使所配溶液的浓度_________(填“偏高”、“偏低”、“无影响”);(4)若定容时加蒸馏水不慎超过刻度线,处理方法是______________________________。
21、(8分)下图是部分短周期元素的单质熔点的变化图:根据此图,填写下列空白:
(1)图中⑦号元素位于周期表第_____________周期,第____________族
(2)图中⑥号元素的最高价氧化物对应的水化物呈两性,该化合物与氢氧化钠溶液反应的离子方程式为____________________________________________
(3)图中③号与⑧号能形成分子式为XY2型的化合物,用电子式表示该化合物的形成过程___________________________________________________
(4)⑦号元素与氧元素形成的化合物其晶体属于____________,若要使其熔化,需破坏的作用力是____________________________
22、(6分)物质X是中学化学中的常见物质,X既能与稀硫酸反应,又能与氢氧化钠溶液反应。
(1)若X为氧化物,X的化学式为_______________________
(2)若X为单质,X用于焊接钢轨反应的化学方程式为__________________________
(3)若X与稀硫酸反应生成一种无色无味的气体A,与浓氢氧化钠溶液在加热条件下反应生成一种无色有刺激性气味的气体B,等物质的量的气体A和气体B在水溶液中反应又生成X。则X与足量稀氢氧化钠溶液反应的离子方程式是____________________________。
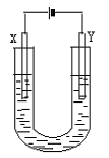 23、(10分)右图是用石墨和铁作电极电解饱和食盐水的装置。请填空: 23、(10分)右图是用石墨和铁作电极电解饱和食盐水的装置。请填空:
(1)Y的电极材料为铁,所发生的电极反应为________________________
检验X极产物的方法是___________________________________
(2)某同学在实验时误将两种材料接反,导致X极上未得到预期产物。一段时间后该同学发现U型管中出现白色沉淀,此沉淀是__________________(填化学式);其形成原因是_________________________;该沉淀在空气中放置,现象是___________________________。
24、(6分)某燃料电池以熔融的Na2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的电极反应为:正极:26CO2 13O2 52e- =26CO32-;负极:2C4H10 26CO32-—52e- = 34CO2 10H2O
(1)写出该燃料电池总的化学反应方程式_________________________________
(2)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在正极通入的空气中加入一种物质,其加入的物质是(写化学式)______________;它从哪里来?从________________来。
25、(10分)Cu、CuO、Cu2O组成的混合物,加入100mL0.6mol/LHNO3溶液恰好使混合物完全溶解,同时收集到224mLNO气体(标准状况).回答下列问题:
(1)写出Cu2O跟稀硝酸反应的化学方程式______________________________________
(2)产物中硝酸铜的物质的量为____________mol
(3)如混合物中含0.01molCu,则其中Cu2O、CuO的物质的量分别为____________mol、__________________mol。
(4)如混合物中Cu的物质的量为X,其中CuO的物质的量为_____________________(用含X的代数式表示)
湖南省示范性中学07届高三化学百校联考试题
参考答案:
1-5 BDBCB 6-10 BAABD 11-15 ACCAB 16-18 CBB
19、碱式滴定管;稀硝酸;蓝色晶体全部变成白色粉末;4次。
20、27.8g;①②④③⑤;偏低;重新配制。
21、三、ⅣA;Al(OH)3 OH-=AlO2- 2H2O; 原子、共价键。
22、Al2O3;2Al Fe2O3=Al2O3 2Fe;HCO3- NH4 2OH-=NH3·H2O CO32- H2O
23、(1)2H 2e-=H2↑、用湿润的淀粉KI试纸放在管口,若变蓝,证实产生了Cl2;
(2)Fe(OH)2;阴极:Fe-2e-=Fe2 、阳极:2H 2e-=H2↑,生成的OH-与Fe2 结合成
Fe(OH)2;先变灰绿色,后变红褐色。
24、2C4H10 13O2=8CO2 10H2O;CO2,负极。
25、(1)3Cu2O 14HNO3=6Cu(NO3)2 2NO2↑ 7H2O
(2)0.025mol
(3)0.005mol,0.005 mol
(4)(X-0.005)mol
|