| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
(1) K的表达式为: ; (2) 该反应的正反应为 反应(“吸热”或“放热”); (3) 能判定该反应是否已经达到化学平衡状态的是: A.容器中压强不变 B.混合气体中CO浓度不变 C.v(H2)正 = v(H2O)逆 D.c(CO2) = c(CO) (4) 在850℃时,可逆反应:CO2(g) H2(g)
| 时间/min
| CO2 (mol/L)
| H2 (mol/L)
| CO (mol/L)
| H2 O ( mol/L)
| 0
| 0.200
| 0.300
| 0
| 0
| 2
| 0.138
| 0.238
| 0.062
| 0.062
| 3
| c1
| c2
| c3
| c3
| 4
| c1
| c2
| c3
| c3 |
计算:3min—4min达到平衡时CO的平衡浓度c3和CO2 (g)的转化率,要求写出简单的计算过程(c3精确到小数点后面三位数)。
27.(10分)氟化钠是一种用于农作物杀菌、杀虫剂和木材的防腐剂。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵;
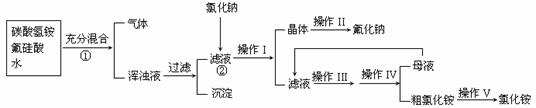
已知:20℃时氯化铵的溶解度为37.2g,氟化钠的溶解度为2g,Na2SiF6微溶于水:
(1)流程①中H2SiF6和NH4HCO3反应得到的NH4F与H2SiO3组成浑浊液,请写出流程②中相关反应的化学方程式:② ;能够发生上述反应的原因: 。
(2)操作I和IV是相同的,请指出其名称 ;
(3)操作II中洗涤沉淀的过程是将漏斗中母液全部滤出后,
;
(4)流程①中NH4HCO3必须过量,其原因是 。
四、(本题包括2小题,但只能选做其中的一个题目):
28.[有机化学基础选做题] (10分)已知:
|
|
![]()
![]()
![]()
![]()
![]() R—CH2—C—CH2—R’
R—CH2—C—CH2—R’
|
|
|
|
已知:A的结构简式为:CH3—CH(OH)—CH2—COOH ,现将A进行如下反应,B不能发生银镜反应, D是食醋的主要成分, F中含有甲基,并且可以使溴水褪色。
|
A |
|
B |
|
HCOOH |
|
C |
|
D |
|
E |
|
F |
|
G(C4H6O2)n |
|
H(C8H12O4) |
|
I (C4H6O2)n |
|
+ |
|
高分子化合物 |
|
高分子化合物 |
|
一定条件 |
|
一定条件 |
|
氧化 Cu、△ |
|
氧化 |
|
浓H2SO4、△ 反应① |
|
+ |
|
浓H2SO4、△ 两分子A酯化反应 |
|
一定条件 反应② |
|
环酯 |
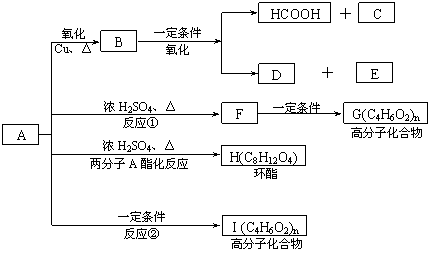 |
(1)写出C、E的结构简式:C_________ _、E_______ ;
(2)反应①和②的反应类型:①____________反应、②____________ 反应;
(3)写出下列化学方程式:
② F→G:_________________________________________________ ;
③ A→H:_________________________________________________ ;
29.[物质结构与性质选做题] (10分).下表列出了前20号元素中的某些元素性质的有关数据:
元素编号
元素性质
= 1 \* GB3 ①
= 2 \* GB3 ②
= 3 \* GB3 ③
= 4 \* GB3 ④
= 5 \* GB3 ⑤
= 6 \* GB3 ⑥
= 7 \* GB3 ⑦
= 8 \* GB3 ⑧
= 9 \* GB3 ⑨
= 10 \* GB3 ⑩
原子半径
(10-10m)
1.52
2.27
0.74
1.43
0.77
1.10
0.99
1.86
0.75
0.71
最高价态
1
+1
-
+3
+4
+5
+7
+1
+5
-
最低价态
-
-
-2
-
-4
-3
-1
-
-3
-1
(1)以上10种元素形成的单质中,与水反应最剧烈的金属是 (填写编号),
非金属性格最强的是 ;
 (2)上述 = 5 \* GB3 ⑤、 = 6 \* GB3 ⑥、 = 7 \* GB3 ⑦三种元素中的两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质的化学式为 、 。
(2)上述 = 5 \* GB3 ⑤、 = 6 \* GB3 ⑥、 = 7 \* GB3 ⑦三种元素中的两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质的化学式为 、 。
(3)某元素R的原子半径为1.02×10-10m,该元素是 ;其电子排布式为________________ ;
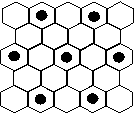
(4)元素 = 5 \* GB3 ⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的 = 2 \* GB3 ②单质相互作用,形成某种青铜色的物质(其中的元素 = 2 \* GB3 ②用“●”表示),原子分布如图所示,该物质的化学式为 。
08届高三第二次调研考试化学答题卷
一、二:选择题目
|
班级 姓名 考号 考场号 |
|
密 封 线 内 不 得 答 题 |
 三、(本题包括3小题,共30分)
三、(本题包括3小题,共30分)
21.(10分) (1). 第 周期、第 族,E的元素符号为:_____________ ;
(2). ____________________________ ;
(3). ______________________________________________________________________ ;
(4)__________________________ 。
22.(10分) (1) ;
(2) ;
(3) 。
(4):(一):
[判定猜想]: ;
(二):
[验证(操作)过程]:
;
[实验现象]:
;
由上述实验得出的结论:滤液中的主次成分:
.
23.(10分)(1) ;
, ;
(2) ;
;(3) 。
四、(本题包括2小题,共20分)
24.(10分)(1) ;
(2)
;
(3)
优点:
;
(4) 、
。
25.(10分)(1)____________反应; G:______________ ;
(2)___________________________________________ ;
(3)___________________________________,E:_____________ ;
(
4)⑨___________________________________________ 。
五、(本题包括2小题,共20分)
26.(10分)、(1) K= ;
(2) 反应(“吸热”或“放热”); (3)、 ;
 |
27.(10分)(1)② ;
原因: ;
(2) 、 ;
(3)
(4)
。
四、(本题包括2小题,但只能选做其中的一个题目):
第28或29题选做题.请选择题号第 题 (10分)
(1)、 __________ 、___________ ;
(2)____________ 、____________ ;
(3)
①_________________________________________________ ;
②_______________________________________________ ;
(4) ;(第29题的同学填此空)
08届高三第二次调研考试化学参考答案
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
B
C
B
C
B
B
D
C
C
A
BD
D
BC
C
D
AC
C
AC
AD
A
三、(本题包括3小题,共30分)
21.(10分) (1)第二周期 、第ⅥA族 (2分) ; Cl (2分)
(2)2Na2O2 2CO2 2Na2CO3 O2(2分)
(3)2Al+2OH-+2H2O=2AlO2-+3H2↑ [或2Al+2OH-+4H2O=2Al(OH)4-+3H2↑] (2分)
(4)OF2(2分)
![]()
(3) 炭(或碳、或C) (1分)
(4) (一):[判定猜想]:猜想I不成立 (1分)
(二):[验证(操作)过程]:取少量滤液逐滴滴入稀氨水 1分)
[实验现象]:先有白色沉淀、滴入过量稀氨水后白色沉淀溶解(2分);
[判定猜想]:结论:主要为氯化锌,其中含少量的氯化铵(2分。
[若说成氯化铵和氯化锌的混合物给1分;若说成只有氯化锌没有氯化铵0分]
23.(本题共10分)(1)2MoS2 7O2= 2MoO3 4SO2 (2分) ;
SO2(1分) ;回收SO2 再利用 (或回收SO2联合生产硫酸和化肥 2分)
(2)MoO3+2NH3·H2O=2NH ![]() MoO
MoO ![]() +H2O (2分) ; 不是(1分)
+H2O (2分) ; 不是(1分)
(3)CO(2分)
四、(本题包括2小题,共20分)
24.(10分)(1)BC (3分,若只选一个对的得1分,全对得3分)
(2)循环过程需要很高的能量,且使用重金属汞,会产生污染。 (2分)
(3) SO2 I2 2H2O ![]() 2HI H2SO4 (2分)
2HI H2SO4 (2分)
SO2和I2可循环使用,无污染。 (1分)
(4)不现实,理由是现有的制取氢气方法耗能大,制取的成本太高,另外是氢气的熔沸点太低,给储存和运输带来困难。
[或:现实,制取氢气用水为原料,来源丰富;氢气燃烧的产物是水,不会给环境带来任何污染等。(2分)]
25.(10分) ⑴ 取代反应 (1分) ;HOOCCH=CHCOOH (2分)
⑵
![]() (2分)
(2分)
⑶ 保护A分子中C=C不被氧化 (1分) ; ![]() (2分)
(2分)
(4) BrCH2CH2Br 2 H2O ![]() HCH2CH2H 2 H Br (2分)
HCH2CH2H 2 H Br (2分)
五、(本题包括2小题,共20分)
26.(10分)(1) ![]() ;(2分) ;(2)放热;(2分)
;(2分) ;(2)放热;(2分)
(3)B、C; (3分,若只选一个对的得1分,全对得3分)
(4)设3min—4min达到平衡时CO、H2 O的平衡浓度为c3, 则CO2 、H2的平衡浓度分别为0.200-c3和0.300- c3
根据: K= c3·c3/(0.200-c3)·(0.300-c3)= 1 (1分)
c3=0.120mol/L (1分,写0.12的不给分) ;
CO2 (g)的转化率 : 0.120/0.2×100% = 60% (1分)
27、(10分)(1) ② NH4F NaCl==NaF↓ NH4Cl (2分);NaF 的溶解度比NH4F的溶解度小得多(2分)
(2)过滤(2分)
(3)再在滤纸上加蒸馏水至恰好浸没晶体,静置让其滤出,重复操作2-3次,以除去晶体表面的杂质(2分)
(4)必须保证①中H2SiF6能全部反应,防止导致②中生成Na2SiF6沉淀(2分)
四、(本题包括2小题,但只能选做其中的一个题目):
28.[有机化学基础选做题] (10分,方程式每个2分)
(1)C:HOOC—CH2—COOH (2分)、 E:HOOC—COOH(2分)、
(2)消去,缩聚(各1分,共2分,答聚合也给分)
(3)
|
一定条件 |
 ②
②
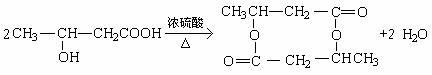 |
③
29.[物质结构与性质选做题] (10分)(2分)(1) ② (1分) 、F (1分) (2) PCl3、CCl4(2分)(3) S (或硫) (2分); 1S22S22P63S23P4(2分);(4) KC8(2分)
| |