| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
三、填空题(62分) 17.(8分)下列说法中,正确的是(填序号)_____________ A AgCl NaBr=AgBr NaCl能在水中进行,是因为AgBr比AgCl更难溶于水 B 用渗析法分离淀粉中混有的氯化银杂质 C 可以用分液漏斗将甘油和水的混合液体分离 D 用碱式滴定管量取20.00毫升高锰酸钾溶液 E 配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止 F 在氢氧化铁胶体中加入少量硫酸会产生沉淀 G硝酸银溶液通常保存在棕色的试剂瓶中,是因为硝酸银见光易分解 18.(8分)工业甲醇的质量分数可以用下列方法测定: ①在稀H2SO4中甲醇被Cr2O72—氧化成CO2和H2O,反应式为: CH3OH+Cr2O72—+8H+=CO2↑+2Cr3++6H2O; ②过量的Cr2O72—可用Fe2+与之完全反应: _____Cr2O72—+_____Fe2++_____H+ ——_____Cr3++______Fe3++______H2O 现有0.12 g工业甲醇,在H2SO4溶液中与25 mL 0.2 mol·L-1K2Cr2O7溶液反应,多余的K2Cr2O7再用1 mol·L—1FeSO4与其反应,结果用去FeSO4溶液9.6 mL。 ⑴配平第②步中离子方程式。 ⑵工业甲醇的质量分数为 。 19.(8分)用 A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.20mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶 (1)实验时应选用仪器的先后顺序是(填入编号)_________________________。 (2)在容量瓶的使用方法中,下列操作不正确的是(填写编号)___________________。 A.使用容量瓶前检查它是否漏水B.容量瓶用蒸馏水洗净后,再用待配溶液润洗 C.配制溶液时,假如试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加 6 入蒸馏水到接近标线2cm~3cm处,用滴管滴加蒸馏水到标线 D.配制溶液时,假如试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近容量瓶刻度标线1cm~2cm处,用滴管滴加蒸馏水到刻度线 E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次 20.(8分)有一无色透明溶液,欲确定是否含有下列离子:Na 、Mg2 、Al3 、Fe2 、Ba2 、NO
| 实验步骤
| 实验现象
| ①取少量该溶液,加几滴甲基橙
| 溶液变红色
| ②取少量该溶液,浓缩,加Cu片和浓H2SO4,加热
| 有无色气体产生,后在空气中又变成红棕色
| ③取少量该溶液,加BaCl2溶液
| 有白色沉淀生成
| ④取③中上层清液,加AgNO3溶液
| 有白色沉淀生成,且不溶于HNO3
| ⑤取少量该溶液,加NaOH溶液
| 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
(1)溶液中肯定存在的离子是________________________。
(2)溶液中肯定不存在的离子是________________________。
(3)为进一步确定其他离子,应该补充的实验是________ _ ________
。
21.(6分)将5.1 g镁铝合金溶于600 mL 0.5 mol·L-1H ![]() SO
SO ![]() 溶液中,完全溶解后再加入
溶液中,完全溶解后再加入
1.0 mol·L-1的NaOH溶液,得到沉淀的质量为13.6 g,继续滴加NaOH溶液时则沉淀会减少。
(1)当加入 ▲ mLNaOH溶液时,可使溶解在硫酸中的Mg ![]() 和Al
和Al ![]() 恰好完全沉淀。
恰好完全沉淀。
(2)计算合金溶于硫酸时所产生的氢气在标准状况下的体积。(列出算式)
22.(12分)由乙烯和其他无机原料合成环状化合物其合成过程如下(水及其他无机产物均已省略):

![]()
请分析后回答下列问题:
(1)反应的类型分别是①___________、②________________;
(2)D物质中的官能团为___________________________;
(3)C物质的结构简式___________________,物质X与A互为同分异构体,则X
的结构简式为_________________,X的名称为_______________________________;
(4)B、D在一定条件下除能生成环状化合物E外,还可反应生成一种高分子化合物,试写出B、D反应生成该高分子化合物的方程式
23.(12分)臭氧(O3)能与KI溶液反应, 生成氧气等。在反应后的溶液中滴入酚酞变为红色。若滴入淀粉则变为蓝色。为测定环境中空气的臭氧含量, 将0℃、1.01×105Pa的空气33.6m3通过KI溶液, 使反应完全, 在所得溶液中用0.0100mol·L-1的Na2S2O3溶液60.0mL恰好滴定达终点, 反应为:
![]()
(1)臭氧通入KI溶液中的化学方程式是 ,每消耗1molO3,转移__________ mol e-
(2)计算大气中臭氧的体积分数。(写出计算过程)
第Ⅱ卷(非选择题,共64分)
请同学们把1~16答案填入下表:
题号
1
2
3
4
5
6
7
8
答案
D
C
C
C
C
A
D
B
题号
9
10
11
12
13
14
15
16
答案
A
A
D
D
A
C
C
B
17. (6分每空2分). AEFG(
18.(11分)⑴1、6、14、2、6、7 (2分)
⑵由反应②可知,反应①剩余的n(Cr2O72—)= ![]() n(Fe2+)=0.0016 mol (3分)
n(Fe2+)=0.0016 mol (3分)
反应①消耗的n(Cr2O72—)=0.0050 mol-0.0016 mol=0.0034 mol
则n(CH3OH)=0.0034 mol (3分)
w(CH3OH)= ![]() ×100%=90.7% (3分)
×100%=90.7% (3分)
19.(1)G、E、C、H、F或E、G、C、H、F (3分) (2)B、C、D(3分)
20.(8分)(1)Mg2 、Al3 、NO ![]() 、SO
、SO ![]() (2分)
(2分)
(2)Fe2 、Ba2 、I-、HCO ![]() (2分)
(2分)
(3)焰色反应,取少量原溶液,加入Ba(NO3)2溶液后,取上层清液加入AgNO3溶液和稀HNO3(4分)
21.600 5.6L
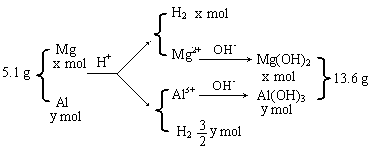
![]()
![]() 列式: 24x 27y=5.1 解得: x=0.1
列式: 24x 27y=5.1 解得: x=0.1
58x 78y=13.6 y=0.1 (3分)
氢气的体积为:(0.1 ![]() ×0.1)×22.4=5.6(L)(1分) 其它合理解法参照给分。
×0.1)×22.4=5.6(L)(1分) 其它合理解法参照给分。
22.加成 酯化 羧基 OHC-CHO 1.2-二溴乙烷
23、(8分)
(1)2KI O3 H2O = 2KOH O2 I2 (2分) 2 (2分)
(2)(4分)解: n(Na2S2O3) = 0.0100mol·L-1×60.0×10-3L = 6.00×10-4mol(1分)
设: 33.6m3空气中O3的物质的量为x。
关系式:
2Na2S2O3 ~ O3 (1分)
2mol 1mol
6.00×10-4mol x
x = 3.00×10-4mol (1分)
空气中O3的体积分数 = ![]() = 2.00×10-5%(2分)
= 2.00×10-5%(2分)
| |