| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
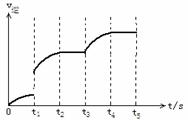
以下填空都要用符号表示: (1)由表中①⑥⑩三种元素形成的离子化合物的电子式___________,据说王水中含有由表中⑥⑦⑩三种元素组成的三原子分子的物质,该分子中所有原子都达到了稳定结构,试写出此种分子的电子式_____________。 (2)周期表中同一主族元素性质相似,但我们发现主族中左上方元素与右下方元素的性质也相似,如:③和⑧。写出③的氢氧化物与强碱溶液反应的离子方程式__________________________________;②的单质在空气中燃烧可能生成的物质的化学式_______________。 (3)表中原子⑧的电子排布式为_____________,原子④核外有_____个运动状态不同的电子,原子⑤核外有_______个未成对电子。 (4)俗称“矾”的一类物质通常含有的共同元素是表中的______。一般认为能构成物质种数最多的是表中的元素⑤,但也有人认为是表中的元素___。 24、某主族元素R的单质可被稀HNO3氧化为R3 ,R3 最外层有两个电子,在碱性条件下,R3 可被Cl2再氧化成带一个单位负电荷的含氧酸根离子,该阴离子在酸性条件下能将MnSO4溶液中的Mn2 氧化成高锰酸根离子,同时本身被还原成R3 。R元素与Cs元素同周期。写出R3 与Cl2反应、R的含氧酸根离子氧化MnSO4的离子方程式 (1)__________________________________________ (2)__________________________________________ 标出反应(1)中电子转移的方向和总数,反应(2)可否用HCl酸化溶液__________(不可以的话要简述理由)? 25、可逆反应Fe(s) CO2(g) (1)写出该反应的平衡常数表达式____________________ (2)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,假如改变下列条件再达平衡后(选填“增大”、“减小”、“不变”) ①升高温度,CO2的平衡浓度__________,②再通入CO2,CO2的转化率___________, ③增大容器的体积,混和气体的平均分子量_________。 (3)该反应的逆速率随时间变化情况如图: ①从图中看到,反应在t2时达平衡,在t1时改变了某种条件,改变的条件可能是_______________(填序号,
a. 升温 b. 增大CO2的浓度 c. 使用催化剂 d. 增压 ②假如在t3时再增加CO2的量,t4时反应又处于新平衡状态,请在图上画出t3~t5时间段的v逆变化曲线。 (4)能判定该反应达到平衡的依据是 。 A、容器内压强不变了 B、c(CO)不变了 C、v正(CO2)=v逆(CO ) D、c(CO2)=c(CO) 五、(本题共24分) 26、晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下: ①高温下用过量的碳还原二氧化硅制得粗硅; ②粗硅与干燥的HCl气体反应制得SiHCl3 (Si 3HCl→SiHCl3 H2) ③SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅,已知SiHCl3能与水强烈反应,在空气中易自燃。 请回答: (1)第一步制取粗硅的化学方程式___________________ (2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3可采用________的方法。 (3)实验室用SiHCl3与过量的H2反应制取纯硅的装置如图所示(加热器和夹持装置略去):
① 装置B中的试剂是________,装置C需水浴加热,目的是________。 ② 反应一段时间后,装置D中可观察到有晶体硅生成,装置D不能采用普通玻璃管的原因是__________,D中发生的反应的化学方程式是________________________。 ③ 为保证实验的成功,操作的要害除题中已告知的之外,你认为最重 要的还有: __________________________(说出三点)。 27、某化工厂生产皓矾(ZnSO4·7H2O),结晶前的饱和溶液(呈酸性)中含有少量Cu
(1)加入的试剂②最好是 (填名称),其主要作用是 。 (2)为了调整溶液的pH,加入试剂③,供选用的试剂有NaOH、Na2CO3、ZnCO3、NH3·H2O、Ca(OH)2等,应当选用 ,理由是 。(3)从溶液中获得皓矾的操作依次是_______________________。 28、你留意过标签上的化学吗? (1)这是某品牌休闲西服标签上的部分内容:
| 等级:特级 成份:面料 羊毛80% 绦纶20% 里料 绦纶100%
|
| 熨烫标准:中温,不超过150℃ |
回答 ①其中属于合成纤维的是____________
②从此标签中可感觉羊毛、绦纶两种纤维的共同点有________。
③将面料、里料中各抽出一根来点燃,可观察到的现象是_______。
(2)某化肥厂生产的一种化肥,其包装袋上标有:
硝酸铵(NH4NO3)
净重 50kg
含氮量≥31.5%
![]()
①该厂生产的每一袋这种化肥中NH4NO3的质量应不少于_____kg。
②某些汽车的安全气囊中也装有NH4NO3,它在高温或猛烈撞击时,会迅速反应,产生大量气体,从而避免驾驶员受伤。其原理是:
2NH4NO3→2N2↑ O2↑ 4H2O↑
③在使用此化肥时,你最想关照农民大哥的事情是 (至少说出两点)。
六、(本题共20分)
29、A、B、C均是由碳、氢、氧三种元素组成的有机物,它们的相对分子质量相等,但碳原子数依次减少1个,已知: ①A中C、H、O的原子个数比为5:12:2, ②A不能发生消去反应,但能与C发生缩聚反应生成聚酯D,③B的水溶液呈酸性,分子中无甲基,一定条件下分子内可脱水生成环状有机物E。写出
(1)A、B、D的结构简式__________ ____________ ___________
(2)与B为同类物质但互为同分异构体的所有可能的结构简式
__________________________________________________________
30、利用芳香烃X和链烃Y可合成紫外线吸收剂BAD。BAD结构简式为:

已知G不能发生银镜反应,BAD的合成路线如下:

试回答下列问题:
(1)写出结构简式:G_________,D_________。
(2)属于取代反应的有____________(填序号)
(3)1mol BAD最多可与含________mol NaOH的溶液完全反应。
(4)写出反应方程式:
反应④_______________________________________________
反应⑤_______________________________________________
七、(本题共16分,要有计算过程。)
31、用沉淀法测定NaHCO3 和K2CO3混合物的组成。实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液500mL,每次实验均充分反应。实验记录如下:
|
实验次数 |
样品质量/g |
沉淀质量/g |
|
1 |
1.716 |
2.758 |
|
2 |
2.574 |
|
|
3 |
3.432 |
5.516 |
|
4 |
4.290 |
5.516 |
回答下列问题:
(1)第2次实验中产生沉淀的质量是
(2)Ba(OH)2溶液的物质的量浓度为____________
(3)第2次样品中含NaHCO3的物质的量为_____________
(4)取第2 次实验所得溶液体积的 ![]() ,加水配制成500mL溶液,pH=
,加水配制成500mL溶液,pH=
32、实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入5mol·L ![]() 的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如下图所示。则
的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如下图所示。则
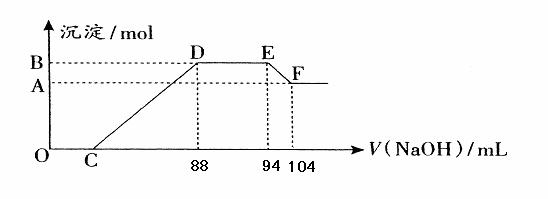
(1)B与A的差值为: mol。
(2) C点对应的溶液体积为: mL。
(3)原硝酸溶液中含硝酸的物质的量为: mol。
2008年十校联考试题参考答案
一、1、B 2、D 3、D 4、C 5、C
二、6、A 7、A 8、D 9、B 10、D 11、C 12、B 13、D 14、D
15、C 16、D 17、A
三、18、B、D 19、B 20、C、D 21、B、C 22、B
四、(本题共24分)
H
‥ ‥ ‥ ‥ ‥
23、(1)[H︰N︰H] [︰Cl︰]ˉ (1’) ︰O︰︰N︰Cl︰ (1’)
‥ ‥ ‥
H
(2)Be(OH)2 2OHˉ→BeO22ˉ 2H2O(1’),Li2O、Li3N (2’ 写Li2O2不扣分)
(3)1s22s22p63s23p1 (1’), 5(1’), 2 (1’)
(4)S、O 、H(1’), H (1’)
2e
_____
| ↓
24、(1)Bi3 Cl2 6OHˉ→BiO3ˉ 2Clˉ 3H2O (3’)
(2)5 BiO3ˉ 2Mn2 14H →2MnO4ˉ 5Bi3 7H2O (2’)
否,HCl将先于Mn2 被BiO3ˉ 氧化 (1’)
 25、(1)k=
25、(1)k= ![]() (1’) (2)减小(1’) 不变(1’) 不变(1’)
(1’) (2)减小(1’) 不变(1’) 不变(1’)
(3)①a、c、d(2’) ②(1’)
(4)B、C(1’)
五、(本题共24分)
高温
26、(1)SiO2 2C ——→ Si 2CO(1’)
(2)分馏(写蒸馏不扣分)(1’)
(3)①浓H2SO4(1’), 使SiHCl3气化(1’)
高温
②普通玻璃管在1000℃~1100℃要熔化(1’),SiHCl3 H2——→Si 3HCl(1’)
③a. 实验前要检查气密性(1’) b. 加热前要先排尽空气(1’)
c.加热温度控制适当(1’)
27、(1)过氧化氢(1’) 将Fe2 氧化成Fe3 (1’)
(2)ZnCO3(1’) 能控制pH在5.7四周,且不引入杂质离子(1’)
(3)蒸发、冷却、过滤、洗涤(3’)
28、(1)①绦纶(1’) ②不耐高温(1’),有可燃性(1’) ③羊毛灼烧时有烧焦羽毛的气味,而绦纶无此现象(1’)
(2)①45(2’) ③a. 若化肥结块,不能用硬器敲击(1’) b. 不要与草木灰等碱性物质共施(1’)
六、(本题共20分)
CH2OH
|
29、(1)CH3—C—CH3 (2’) CH2CH2CH2COOH (2’)
| |
CH2OH OH
O O CH3
‖ ‖ |
-[-C—CH2—C—O—CH2—C—CH2—O-]- n (2’)
|
CH3
CH3
|
(2)CH3CHCH2COOH CH3CH2CHCOOH CH3—C—COOH
| | |
OH OH OH
CH3
|
CH2—CH—COOH (各1’)
|
OH
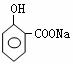 O
O
‖
30、(1)G:CH3C—CH3 (2’) D: (2’)
(2)① ② ⑤ (1’) (3)6(1’)
O
Cu ‖
(4)2CH3CHCH3 O2—→ 2CH3CCH3 2H2O (2’)
| △
OH

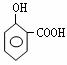
2 —→
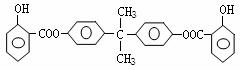 |
2H2O (2’)
七、(本题共16分)
31、(1)4.137g (1’) (2)0.056mol/L (2’) (3)0.006mol (2’)
(4)12 (2’)
32、(1)0.05 (3’) (2)40 (3’) (3)0.5 (3’)
| |