推荐文章
- 化学计算专项训练三及答案
- 化学学科高考模拟试卷
- 化学反应速率和化学平衡
- 化学反应速率 化学平衡
- 化学元素及化合物所有化学方程式
- 08届高三化学第一学期期终考试模拟卷3
- 08届高三化学第一学期期中统一考试
- 08届高三化学第9月测试题
- 08届高三化学碱金属单元测试题1
- 08届高三化学电解质溶液专题练习
- 08届高三化学氧碳氮知识测试
- 08届高三化学暑期统一考试试题
08届高三化学复习三校联考试题
08届高三化学复习三校联考试题
化 学 试 题
(满分100分,考试时间90分钟)
命题:赖 英 审核:李文炜
考生注重:① 试题答案应全部写在答题卷上
②可能用到的相对原子质量:H—1,K—39,S—32,O—16,Na—23,
Fe—56, Al—27, N—14,Ba—137, F—19, Cl—35.5, Br—80, I—127
第I卷 选择题 45分
一、选择题(每题只有一个选项符合题意,1—9每题2分,10—18题每题3分,共45分)
1、20世纪80年代后,人们发现和证实了碳的另一类单质,它们是由一系列偶数个碳原子组成的分子,其中C60(足球烯,分子中含有30个双键)最具代表性。下图所示为n个C60连接而成的物质X。下列有关说法不正确的是
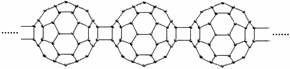
A.常温常压下X为固态且难溶于水 B.一定条件下X可与Cl2发生加成反应
C.X是碳的一种同素异形体 D.X的摩尔质量为720g/mol
2、限用硝酸、硫酸、盐酸、醋酸、钠盐、钾盐、钡盐相互反应,符合离子方程式2H SO ![]() =H2O SO2↑的化学方程式个数有( )
=H2O SO2↑的化学方程式个数有( )
A、4 B、6 C、8 D、12
|
A、以Cu为电极电解饱和食盐水的总反应式:2NaCl 2H2O===2NaOH H2↑ Cl2↑
B、制备Fe(OH)3胶体的化学方程式:FeCl3 3H2O ![]() Fe(OH)3(胶体) 3HCl
Fe(OH)3(胶体) 3HCl
C、少量氢氧化钙溶液与碳酸氢钠溶液混合:
Ca2 2OH- 2HCO ![]() =CaCO3↓ CO
=CaCO3↓ CO ![]() 2H2O
2H2O
|
2H2(g) O2(g)=2H2O(g); ![]()
4、下列说法正确的是(NA表示阿伏加德罗常数)( )
A、Na2O2与H2O反应生成1.12L O2,反应中
转移的电子数为6.02×1022个
B、6.8g熔融的KHSO4中含有0.1NA个阳离子
C、23.4g NaCl晶体中含有0.1NA个如图所示
的结构单元
|
|
转移的电子数为3NA
5、1962年,英国青年化学家以巴特莱特将PtF6和Xe按等物质的量在室温下混合后,首次得到含有化学键的稀有气体化合物六氟合铂酸氙:Xe PtF6=XePtF6
有关此反应的叙述中,正确的是( )
A、Xe是氧化剂 B、PtF6是氧化剂
C、PtF6是氧化剂又是还原剂 D、该反应不属于氧化还原反应
6、分类方法在化学学科的发展中起到非常重要的作用.下列分类标准合理的是( )
①根据盐的组成可分为正盐、酸式盐、碱式盐
②根据每个酸分子中含有的H原子个数将酸分为一元酸、二元酸等
③根据氧化物中是否含金属元素判定这种氧化物属碱性氧化物或两性氧化物
④微粒间相互作用分为离子键、共价键、氢键等化学键和分子间作用力
⑤根据分子中含有苯环分为链烃、芳香烃,如苯乙烯是苯的同系物
A、①② B、① C、①③⑤ D、①④
7、两种短周期元素组成的化合物中原子数比为1:3,若两种元素的原子序数分别是a和b,则a和b的关系可能是① a=b 5 ② a b=8 ③ a b=30 ④ a=b 8
A、①②③④ B、①③④ C、①②③ D、①②④
8、下列离子方程式正确的是( )
A、物质的量相同的NH4HSO4与Ba(OH)2在溶液中反应:
2H SO ![]() Ba2 2OH-=BaSO4↓ 2H2O
Ba2 2OH-=BaSO4↓ 2H2O
B、饱和石灰水跟稀硝酸反应 Ca(OH)2 2H =Ca2 2H2O
C、向Ca(ClO)2溶液中通入少量二氧化硫 Ca2 2ClO- SO2 H2O=CaSO3↓ 2HClO
D、碘化亚铁与少量溴水反应 2I- Br2=I2 2Br-
9、在给定的条件下,下列带点的物质在化学反应中能被完全消耗的是( )
A、用浓盐酸与足量的二氧化锰共热制氯气
B、标准状况下,将1 g铝片投入20ml 18mol /L的硫酸中
C、向100ml 3mol/L的硝酸中加入5.6g铁
D、在5×107Pa、500℃和铁触媒催化剂的条件下,用氮气和氢气合成氨
10、下列各溶液中能大量共存的离子组是 ( )
A.使紫色石蕊溶液呈红色的溶液中: Ag 、Mg2 、Br-、K
B.使PH试纸呈红色的溶液中:Na 、S2O ![]() 、NO
、NO ![]() 、Cl-
、Cl-
C.C(H )=1×10-14mol/L的溶液中:Na 、AlO ![]() 、F-、SO
、F-、SO ![]()
D.水电离出的C(H )与C(OH-)乘积为10-28的溶液中K 、Na 、HCO ![]() 、Ca2
、Ca2
11、同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的是 ( )
A.2Na218O2 2H2O == 4Nal8OH O2↑
B.2KMnO4 5H218O2 3H2SO4 == K2SO4 2MnSO4 518O2↑ 8H2O
C.NH4Cl 2H2O ![]() NH3·2H2O HCl
NH3·2H2O HCl
D.K37ClO3 6HCl == K37Cl 3Cl2↑ 3H2O
12、由氧化铜和氧化铁的混合物ag,加入2mol/L的硫酸溶液50mL,恰好完全溶解,若将ag的该混合物在过量的CO气流中加热充分反应,冷却后剩余固体的质量为( )
A.1.6ag B.(a-1.6)g C.(a-3.2)g D.无法计算
13、下列各组物质的处理方法正确的是( )
①苯和苯酚用分液法分离
②碘与NH4Cl固体用加热法分离
③淀粉溶液中含有NaCl,用渗析法分离
④乙酸乙酯中含有少量乙酸、乙醇,用饱和Na2CO3溶液除去
⑤NaCl和KNO3用重结晶的方法分离
⑥除去NaF溶液中少量的NaCl,可向溶液中通入F2
A、③④⑤ B、②③④ C、①③⑥ D、全部
14、2008年夏季奥运会即将在我国举行,我国支持“绿色奥运,科技奥运,人文奥运”,人文奥运的一个重要的体现是果断反对运动员服用兴奋剂。某种兴奋剂的结构简式为
|
A、 遇FeCl3溶液显紫色,因为该物质与
苯酚互称为同系物
B、 该物质的分子式为C20H24O3,滴入酸
性KMnO4溶液,观察到紫色褪去
C、 1mol该物质与浓Br2水反应时最多消
耗Br2的量为7mol
D、该分子中的所有碳原子不可能共直线,但一定共平面
15、某一容积为2L的密闭容器内,加入0.2mol的CO 和0.2mol的H2O,在催化剂存在的条件下高温加热,发生如下反应: ![]() CO2(g) H2(g);
CO2(g) H2(g); ![]() . 反应达到平衡后,测得
. 反应达到平衡后,测得 ![]() 。下列说法正确的是( )
。下列说法正确的是( )
A、判定该反应达到平衡的依据是CO、H2O、CO2、H2的浓度都相等
B、反应放出的热量为0.04akJ
C、平衡时H2O的转化率为40%
D、将容器的体积压缩为1L,有利于该反应平衡正向移动。
16、被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内的离子“流过”水和氯化锌组成的电解液。电池总反应为: Zn 2 MnO2十H2O = ZnO 2MnO (OH)。下列说法正确的是 ( )
A. 该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当 0.lmol Zn 完全溶解时,流经电解液的电子个数为 1.204×l023
D.电池正极反应式为: 2MnO2 2e一+ 2H2O = 2MnO (OH)十2OH-
17、常温下,0.1mol/L某一元酸HA溶液中 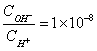 ,下列叙述正确的是( )
,下列叙述正确的是( )
A、溶液中水电离出的c(H )=10-10mol/L
B、溶液中c(H ) c(A-)=0.1mol/L
C、与0.05mol/L NaOH溶液等体积混合后,所得溶液中离子浓度大小关系为:
![]()
D、将NaA溶液加水稀释,溶液中所有离子浓度均减小
18、欲用1L 2mol/L的NaOH溶液、1L 1mol/L的H2SO4溶液和足量的Al粉来制备Al(OH)3,可制得Al(OH)3的物质的量最多为( )
A、 ![]() B、
B、 ![]() C、
C、 ![]() D、
D、 ![]()
第II卷(非选择题共55分)
19、(3分)下列实验操作正确的是
(1)将未经湿润的PH试纸浸到某溶液中,过一会取出与标准比色卡比较测得该溶液的PH值。
(2)使用酸式滴定管盛装KMnO4溶液滴定Na2SO3溶液
(3)将3滴90%浓硫酸滴入蓬松的脱脂棉中搅拌加热,稍冷,再向其中加入2%CuSO4溶液,再加入过量的10%NaOH溶液,并加热至沸腾,可证实纤维素的水解。
(4)直接加热乙醛和银氨溶液的混合液做乙醛的银镜实验.
(5)向蛋白质溶液中加入无机盐(如Na2SO4、(NH4)2SO4)浓溶液,可使蛋白质盐析而分离提纯.
(6)实验室制肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,再经过盐析、分液……等几步处理即可得到肥皂。
(7)配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加浓硫酸.
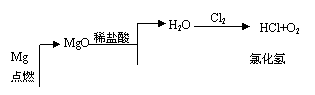
20、(10分)图中表示了另一种将CO2转化为O2的实验设想:
|
MgO |
|
H2O |
|
HCl O2 |
|
Mg 点燃 |
|
稀盐酸 |
|
Cl2 |
|
氯化氢 |
 |
|
|
|
|
|
|
|
| |||||||
|
| |||||||
|
| |||||||
①图中,装置a由 、 双孔塞和导管组成;
②循环物质的名称是 ;
③制取无水氯化镁必须在氯化氢存在的条件下进行,原因是 ;
④装置b中填充的物质可能是 (填入编号)。
A、五氧化二磷 B. 碱石灰 C.无水氯化钙 D.浓硫酸
⑤设计d装置要注重防止倒吸,请在方框中画出d装置的简图,并要求与装置c的出口处相连(铁架台不必画出).
21. (12分)A、B、C、D、E为含同一种元素的常见物质。C物质只由一种元素组成,在每一个C分子中形成共价键的电子数与分子中所含电子数之比为3:7。C和E均可与氧气在一定条件下反应生成A。F是一种常见的还原剂,却是一种能被浓硫酸干燥的气体,请回答以下问题:
(1)常温下将气体B通入水中发生反应,生成A和D,则D为 。
(2)E分子的空间构型是 ;写出E与氧气反应生成A的化学方程式
(3)用电子式表示E的形成过程
(4)D和E生成的化合物在某温度下加热分解,只生成两种氧化物,且在此过程中,若有0.5mol该化合物完全反应,转移电子数2mol。写出该反应的化学方程式:
(5) 某温度下,向某恒压密闭容器中加入相对平均分子质量为8.5的混合气体C和F共4mol使之反应合成E,达平衡后测得E的体积分数为m.保持外界条件不变,只改变起始物质的加入量使反应重新达到平衡后,E的体积分数仍为m.
①若C物质、F物质、E物质的加入量分别用X、Y、W表示,则X、Y、W应满足的关系是
②若使该反应向生成E的方向移动,可采取的措施有(填字母符号)
A、升高温度 B、增大压强 C、使用催化剂 D、液化分离E
|
|
B |
|
A |
|
D |
|
C |
|
E |
|
F |
|
B |
|
E |
|
③ |
|
① |
|
② |
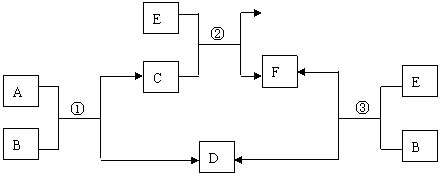
(1) 若反应①、②、③均为水溶液中的置换反应, A、D、E为卤素单质,则A、D、E的氧化性由强到弱的顺序为 (用字母表示),A的化学式是 。
(2)若B是水,C是一种有磁性的化合物,E是一种无色、无味的有毒气体,则反应②的化学方程式是 。
(3)若B为一种淡黄色固体,绿色植物的光合作用和呼吸作用可实现自然界中D和E的循环。反应①的离子方程式是 .在反应③中,若生成1molD,则转移电子数目为 .
23、(14分) 已知:①一定条件下,R1—Cl 2Na R2—Cl→R1—R2 2NaCl;②醛和醇可以发生氧化反应,相关物质被氧化的难易次序是:RCHO最易,R—CH2OH次,R1—(CHOH)—R2最难。已知A为卤代烃,含碳的质量分数为45.86%,含氢元素的质量分数为8.91%,其余为卤元素;B与氯气反应生成的一氯代物有两种,有关的转化关系如图所示(部分产物及条件已略去)
![]()
|
|
|
|
|
|
|
|
|
|
|
|
|
|
![]()
![]()
![]() 浓H2SO4
浓H2SO4
请回答下列问题;
(1)B的结构简式 F的结构简式
(2)I中含有的官能团 (写名称)
(3)反应方程式:H→I ,J→K
(4)请写出D的同分异构体中属于羧酸具有2个—CH3的结构简式
24、(7分)某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为1.96g的该结晶水合物,分别制成溶液。一份加入足量Ba(OH)2溶液,生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;加热上述所得液体,逸出能使湿润的红色石蕊试纸变蓝的气体;用足量稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体2.33g。另一份加入含0.001mol KMnO4的酸性溶液,MnO ![]() 恰好完全被还原为Mn2 。请回答以下问题:
恰好完全被还原为Mn2 。请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是 和 ,阴离子是
(2)该结晶水合物的化学式为
(3)取该结晶水合物溶于水配成浓度为A mol/L的溶液,另有浓度为B mol/L的(NH4)2SO4溶液及C mol/L的(NH4)2CO3溶液,欲使三份溶液的NH ![]() 浓度相等,A、B、C的相对大小关系为 。
浓度相等,A、B、C的相对大小关系为 。
化学参考答案
1~5 D、C、C、C、B 6~10 B、A、D、C、C 11~15 B、B、A、B、C
 16~18 D、C、D
16~18 D、C、D
19、(2)(5) (3分,漏选一个扣2分,错选不给分)
 20、(1)分液漏斗、烧瓶(每空1分)
20、(1)分液漏斗、烧瓶(每空1分)
![]() (2)盐酸 (2分)
(2)盐酸 (2分)
 (3)防止MgCl2的水解(2分)
(3)防止MgCl2的水解(2分)
|
(5)其它有合理答案均可给分
|
(2)三角锥形 (1分) 4NH3 5O2====4NO 6H2O (2分)
|
|
(4)NH4NO3====N2O↑ 2H2O (2分)
(5) 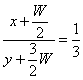 , BD(漏选扣分,错选不给分) (各2分)
, BD(漏选扣分,错选不给分) (各2分)
|
(2)Fe3O4 4CO===3Fe 4CO2 (2分)
(3)2Na2O2 2H2O=4Na 4OH- O2↑, 2NA (每空2分)
|
|
| ||||||
(2)羟基 醛基 (2分)
|
![]() △
△
|
△
|
24、(1)NH ![]() 、Fe2 、SO
、Fe2 、SO ![]() (每空1分)
(每空1分)
(2)(NH4)2Fe(SO4)2·6H2O或(NH4)2SO4·FeSO4·6H2O (2分)
(3)C>B>A (2分)
(所有反应方程式条件不全扣一分:方程式没有配平不给分)