| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
(3)写出过氧化钠与二氧化碳反应的化学方程式:__________________________。 (4)试管F中收集满气体后,下一步实验操作是: 。 23.(17分)A、B、C、D、E是相邻三个周期中的五种元素,它们的原子序数依次增大,B、C、D属同一周期,A、E在周期表中处于同一纵行.已知:①除A外,各元素原子的内层均已填满电子,其中B的最外层有4个电子;②A与B,B与C都能生成气态非极性分子的化合物;③D与E生成离子化合物,其离子的电子层结构相同.回答: (1)A为________元素(填名称,下同),B为________元素, C为________元素,D为________元素,E为________元素; (2)C元素在周期表中属第________周期,________族元素; (3)D与B形成的化合物的电子式________,属________晶体; (4)C与E形成的化合物的电子式为____________和____________,属______晶体. 24.(15分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应: N2(g) 3H2(g) (1) 若反应进行到某时刻 (2) 反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量。 (3) 原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),
(4) 原混合气体中, (5) 达到平衡时,N2和H2的转化率之比, (6) 平衡混合气体中, ⑴在IBr中碘元素的化合价是 ,IBr应属于 晶体。IBr与氢氧化钠溶液反应的离子方程式是 。 ⑵在所有卤素互化物中,沸点最低的应是 (写分子式,下同)。 ⑶若n = 7,则最可能生成的卤素互化物应为 。 = 4 \* GB2 ⑷某卤素互化物与水的反应为 ClFn H2O → HClO3 Cl2 O2 HF,若ClFn与H2O的物质的量之比为3∶5,则n= 。 高三第三次月考化学标准答案 一.选择题(每题4分) 1.B 2.C 3.C 4.A 5.A 6.C 7.A 8.D 9.D 10.B 11.A 12.A 13.C 14.C 15.B 16.B 17C 18A 19.C 20.B 21.D 22.(1)CaCO3 2HCl=CaCl2 CO2↑ H2O (2)
| 仪器
| 加入试剂
| 加入该试剂的目的
| B
|
| 除去CO2气体中氯化氢
| C
| 过氧化钠
| 与CO2和H2O反应生成氧气
| D
|
| 吸收氧氧气中二氧化碳 |
(3) 2Na2O2 2CO2=2Na2CO3 O2
(4)把E中的导管移出水面,关闭分液漏斗活塞,用姆指堵住试管口,取出试管,立即把带火星的木条伸入试管口内,木条复燃,证实试管中收集的气体是氧气。
23.(12分)每线1分 (1)氢,碳,氧,氟,钠; (2)二,ⅥA;
(3) 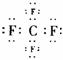 ,分子 (4)
,分子 (4) ![]() , 离子
, 离子
24.(12分)每线2分(1) ![]() =13 3=16。
=13 3=16。
(2) ![]() 平(NH3)=
平(NH3)= ![]() ×25%=32 mol×25%=8 mol
×25%=32 mol×25%=8 mol
(3)5:4 (4)2:3 (5)1:2 (6)3:3:2
25.(1) 1 分子IBr 2OH-=Br- IO- H2O (2)ClF (3)IF7 (4) 3
| |