|
高三化学上学期第四次月考试题
化学试题
(时间90分钟,满分100分)
计算中可能用到的相对原子质量:H 1 O 16 N 14 C 12 S 32 Ca 40
Cu 64 Zn 65
第Ⅰ卷(客观题 50分)
选择题(本题共25小题,每小题只有一个选项符合题意,共50分)
1、2008年北京奥运会“祥云”火炬用的是环保型燃料——丙烷(C3H8),悉尼奥运会火炬所用燃料为65%丁烷(C4H10)和35%丙烷,已知丙烷的燃烧热为:2221.5kJ/mol,下列有关说法正确的是
A.奥运火炬燃烧主要是将化学能转变为热能和光能
B.丙烷的沸点比正丁烷高
C.丙烷、空气及铂片可组成燃料电池,在丙烷四周的铂极为电池的正极
D.丙烷燃烧的热化学方程式为C3H8(g) 5O2(g)=3CO2(g) 4H2O(g);△H=-2221.5kJ/mol
2、下列现象或应用中,不涉及胶体性质的是
A. 在饱和的氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀
B. 清晨,在茂密的树林中,经常可以看到从枝叶间透过的道道光柱
C.用半透膜分离淀粉和食盐的混合液
D.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
3、糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质.下列说法不正确的是
A.淀粉和纤维素均可用  表示,因此它们互为同分异构体 表示,因此它们互为同分异构体
B.淀粉水解的最终产物能发生银镜反应
C.蛋白质溶液中加入饱和硫酸铵溶液后产生的沉淀能重新溶于水
D.脂肪能发生皂化反应,生成甘油和高级脂肪酸钠
4、用下列实验装置完成对应的实验(部分仪器巳省略),能达到实验目的的是
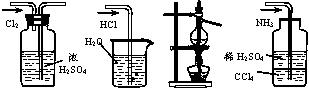
(A)干燥Cl2 (B)吸收HCl (C)石油的分馏 (D)吸收NH3
5、下图是化学能与电能相互转换的两套装置。对此两套装置的分析正确的是
A.两装置中,铁电极上均有气体产生
B.图2装置能将电能转化为化学能
 C.石墨电极上发生的电极反应均为 2H 2e-=H2↑ C.石墨电极上发生的电极反应均为 2H 2e-=H2↑
D.随着反应的进行,两装置中电解质溶液的pH均增大
6、2007年下半年,我国接连发生多起煤矿爆炸事故,造成重大人员伤亡和财产损失。煤矿发生爆炸事故的元凶是煤矿坑道气中含有的甲烷。下列关于甲烷的叙述中错误的是
A.甲烷分子是一种呈正四面体型的、含极性键的非极性分子
B.甲烷分子中两个氢原子被氯取代后,可形成两种不同结构的分子
C.甲烷是重要的化工原料,其分解产物可用于合成氨和橡胶工业
D.“抽”出坑道中的甲烷,既可用作清洁燃料,又可防止爆炸
7、2007年7月20日美国科学家在《天体物理杂志通讯》上发表论文,称“找到了到目前为止人类在太空中发现的最大的阴离子”,该粒子化学式为C8H-,结构简式为HC≡C-C≡C-C≡C-C≡C—。下列关于该阴离子的推断正确的是
A.一个阴离子含有32个价电子
B.该离子能与溴水、酸性高锰酸钾依次发生氧化、加成反应
C.在一定条件下,1molC8H-与8molH2完全反应生成辛烷
D.在酸性溶液中,该阴离子与H 反应生成1,3,5,7-辛四炔
8、2007年8月22日,厦大科学家首次合成罕见铂纳米晶体. 它在能源、催化、材料、化工等领域具有重大的意义和应用价值。铂在中学化学中有广泛应用。下列说法中不正确的是
A.纳米铂晶体在火焰上灼烧呈无色
B.氨气催化氧化反应中铂纳米晶体的催化效率比普通铂丝效率大
C.铂丝可以作燃料电池的负极,可燃气体在负极上发生氧化反应
D.纳米铂晶体与硝酸能反应,而铂不溶于硝酸
9、下列表示物质变化的化学用语中,错误的是
A.钢铁被腐蚀时可能发生的正极反应:2H2O O2 4e— =4OH—
B.明矾水解的离子方程式:Al3 3H2O  Al(OH)3 3H Al(OH)3 3H
C.向KHSO4溶液中滴入Ba(OH)2溶液使pH=7:
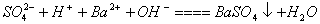
D.氢氧化钠和少量氢硫酸反应: 2OH— H2S=S2— 2H2O
10、某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度。有关的叙述中,正确的是
A .H2Y在电离时为:H2Y H2O  HY- H3O HY- H3O
B .在NaHY的溶液中,离子浓度为:c(Na )>c(Y2-)>c(HY-)>c(OH-)>c(H )
C.在Na2Y的溶液中,离子浓度为:c(Na )>c(Y2-) >c(HY-)>c(OH-)>c(H )
D. HY-的水解方程式为:HY- H2O  H3O Y2- H3O Y2-
11、下列关于工业生产说法不正确的是
A、电解精炼铜时,用粗铜做阴极,纯铜做阳极
B、在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率
C、在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室
D、在侯氏制碱工业中,向饱和氯化钠溶液中先通氨气,后通二氧化碳
12、“非典型肺炎”曾在我国部分地区流行,严重危害广大人民的身体健康。
做好环境消毒是预防“非典型肺炎”的重要措施,常用的消毒剂是ClO2或Cl2等的稀溶液,其中ClO2溶液的消毒效果较好。已知ClO2常温下呈气态,其分子构型与水分子的分子构型相似,在自然环境中ClO2最终变为Cl-。下列有关说法中正确的是
A.ClO2的分子结构呈V型,属非极性分子
B.ClO2中氯元素显+4价,具有很强的氧化性,其消毒效率(以单位物质的量得电子的数目表示)是Cl2的5倍
C.ClO2、Cl2的稀溶液用于环境消毒,具有广谱高效的特点,对人畜无任何危害
D.常用Na2SO3在H2SO4的酸性条件下,还原NaClO3来制ClO2,这一反应的化学方程式可表示为Na2SO3+2NaClO3+H2SO4=2Na2SO4+2ClO2↑+H2O
13、在甲乙两个烧杯中分别放入20mLpH相同的盐酸和醋酸,向两烧杯中同时加入质量相等的铝片,反应结束后,得到等量的氢气。下列分析与实验结果可能相符的是
A.甲烧杯中的酸过量,乙烧杯中的酸完全反应。
B.乙烧杯中的酸过量,甲烧杯中的酸完全反应。
C.两烧杯中的铝片均过量。
D.反应过程中,甲烧杯中的 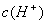 始终比乙烧杯中的 始终比乙烧杯中的 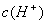 大。 大。
14、下图  为直流电源, 为直流电源,  为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,  为电镀槽.接通电路后发现 为电镀槽.接通电路后发现  上的c点显红色.为实现铁上镀锌,接通 上的c点显红色.为实现铁上镀锌,接通  后,使c、d两点短路.下列叙述正确的是 后,使c、d两点短路.下列叙述正确的是
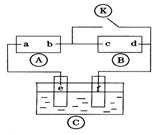 A.a为直流电源的负极 A.a为直流电源的负极
B.c极发生的反应为 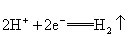
C.f电极为锌板
D.e极发生还原反应
15、 常温下,向一定浓度的氨水中逐滴加入盐酸,在此过程中,下列说法正确的是
(A)当pH>7时,c(Cl—)>c( 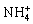 )>c(OH—) >c(H ) )>c(OH—) >c(H )
(B)当pH=7时,c( 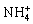 )>c(Cl—)>c(H )=c(OH—) )>c(Cl—)>c(H )=c(OH—)
(C)当pH<7时,c( 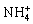 )>c(Cl—)>c(H )>c(OH—) )>c(Cl—)>c(H )>c(OH—)
(D)当氨水与盐酸恰好完全反应时,c(Cl—)>c(  )>c(H )>c(OH—) )>c(H )>c(OH—)
16、下列叙述中不正确的是
A.一定浓度的醋酸钠溶液可使酚酞试液变红,其原因是发生了如下反应:
CH3COO- H2 O  CH3COOH OH-使得溶液中的c(OH-)>c(H ) CH3COOH OH-使得溶液中的c(OH-)>c(H )
B.在0.1mol/LNa2CO3溶液中:2c(Na )=c(H2CO3) c(CO32-) c(HCO3-)
C.在0.1mol/LNH4Cl溶液中:c(H ) c(NH4 )=c(Cl-) c(OH-)
D.将0.2mol/L的醋酸与0.1mol/L的氢氧化钠溶液等体积混合,其溶液中离子浓度由小到大的顺序为:
c(OH-)<c(H )<c(Na )<c(CH3COO-)
17、某温度下,反应H2 (g) I2 (g)  2HI (g);△H<0,在带有活塞的密闭容器中达到平衡;下列说法中正确的是 2HI (g);△H<0,在带有活塞的密闭容器中达到平衡;下列说法中正确的是
A.体积不变,升温、正反应速率减小
B.温度、压强均不变,充入HI气体,开始时正反应速率增大
C.温度不变,压缩气体的体积,平衡不移动,颜色加深
D.体积、温度不变,充入氮气后,正反应速率将增大
18、铜粉放入稀H2SO4中,加热后无明显现象,当加入一种盐后,铜粉质量减小,溶液变蓝,同时有气体逸出,此盐可能是
A.FeSO4 B.Na2CO3 C.KNO3 D.KCl
19、氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHC1O3=bO2↑ cC12↑ dHC1O4 eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是
A.物质HC1O4的氧化性大于HC1O3
B.变蓝的淀粉碘化钾试纸褪色可能发生的反应:5C12 I2 6H2O=12H 10C1- 2IO3-
C.若化学计量数a=8,b=3,则该反应转移电子数为12e-
D.氯酸分解所得O2和C12的物质的量之比是确定不变的
20、用来表示可逆反应:2A(g) B(g)  2C(g)(正反应为吸热反应)的正确图像是 2C(g)(正反应为吸热反应)的正确图像是
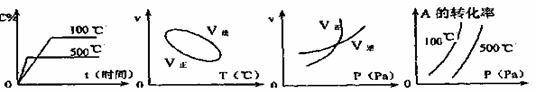 A. B. C. D. A. B. C. D.
|
硫酸 化学纯(CP)
(500mL)
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84g/cm3
质量分数:98% |  21、右图是某学校实验室从化学试剂商店买回的硫酸试剂 21、右图是某学校实验室从化学试剂商店买回的硫酸试剂
标签上的部分内容。据此下列说法正确的是( )。
A.该硫酸的物质的量浓度为9.2mol/L
B.1molZn与足量的该硫酸反应产生2g氢气
C.配制200mL4.6mol/L的稀硫酸需取该硫酸50 mL
D.该硫酸与等质量的水混合所得溶液的物质的量浓度
大于9.2mol/L
22、将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g) Y(g)  2Z(g);△H<0。当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡比较,正确的是 2Z(g);△H<0。当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡比较,正确的是
|
|
改变的条件 |
新平衡与原平衡比较 |
|
A |
升高温度 |
X的体积分数变大 |
|
B |
增大压强 |
Z的浓度不变 |
|
C |
充入一定量Y |
Y的转化率增大 |
|
D |
充入一定量Z |
X的体积分数变大 |
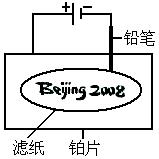 23、某学生设计了如下图所示的“黑笔写红字”的趣味实验。滤纸上先用NaCl和无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹——“ 23、某学生设计了如下图所示的“黑笔写红字”的趣味实验。滤纸上先用NaCl和无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹——“  ”。据此,下列叙述不正确的是( ) ”。据此,下列叙述不正确的是( )
A.铅笔作阴极,电极反应为:2H 2e- = H2↑
B.铂片作阳极:电极反应为:2Cl- - 2e- = Cl2↑
C.铅笔与滤纸接触处有少量Cl2逸出
D.上述反应总的离子方程式可表示为
2Cl- 2H2O  Cl2↑ H2↑ 2OH- Cl2↑ H2↑ 2OH-
24、己烯雌酚是一种激素类药物,结构如下所示,下列有关叙述中不正确的是
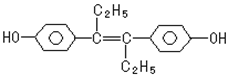 A. 该药物可以用有机溶剂萃取 A. 该药物可以用有机溶剂萃取
B. 该有机物可与NaOH和NaHCO3发生反应
C.1mol该有机物可以与5mol Br2发生反应
D.该有机物分子中,可能有16个碳原子共平面
25、“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂。其中没食子儿茶素(EGC)的结构如下图所示。关于EGC的下列叙述中正确的是
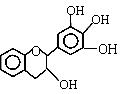 A、分子中所有的原子共面 A、分子中所有的原子共面
B、1molEGC与4molNaOH恰好完全反应
C、易发生氧化反应和取代反应,难发生加成反应
D、遇FeCl3溶液不发生显色反应
第Ⅱ卷(主观题50分)
26、(3分)下列实验操作能达到的预期效果的是______________。
A.用pH试纸测定某液体是否为酸。
B.实验室制乙烯时必须将温度计的水银球插入反应液中以控制反应液的温度。
C.分离苯和苯酚的混合液,先加入适量浓溴水,再过滤、分液,即可实现。
D.向2 mL 2%硝酸银溶液中滴加稀氨水至产生的沉淀恰好溶解即得银氨溶液。
E.向20 mL沸水中滴加数滴饱和FeCl3的溶液,加热片刻,可制得Fe(OH)3胶体。
F.将10滴溴乙烷加入1 mL10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子。
 27、(17分)某有机物X(C12H13O6Br)分子中含有多种官能团,其结构简式为 27、(17分)某有机物X(C12H13O6Br)分子中含有多种官能团,其结构简式为
(其中I、II为未知部分的结构)
为推测X的分子结构,进行如下图的转化:
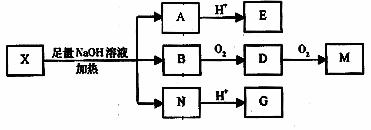 已知向E的水溶液中滴入FeCl3溶液发生显色反应;M(C2H2O4)能使蓝墨水褪色;G、M都能与NaHCO3溶液反应。 已知向E的水溶液中滴入FeCl3溶液发生显色反应;M(C2H2O4)能使蓝墨水褪色;G、M都能与NaHCO3溶液反应。
请回答:
(1)M的结构简式为 ;G分子所含官能团的名称是 ;
(2)E可以发生的反应有(选填序号) ;
①加成反应 ②消去反应 ③氧化反应 ④取代反应
(3)由B转化成D的化学方程式是 ;
(4)G在一定条件下发生反应生成分子组成为C4H4O4的有机物(该有机物可使溴的四氯化碳溶液褪色),写出G发生此反应的化学方程式
(5)已知在X分子结构中,I里含有能与FeCl3溶液发生显色反应的官能团,且E分子中苯环上的一氯代物只有一种,则X的结构简式是
(6)F与G互为同分异构体,F的分子中只含有羧基、羟基和醛基三种官能团,且同一个碳原子上不能同时连有两个羟基。则F的分子结构有 种。
28、(14分)为了证实铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。 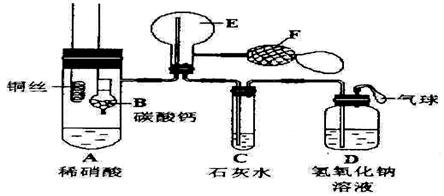
(1)实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,马上将B装置上提,使之与稀硝酸分离。该组学生设计此步操作的目的是
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为 。装置E中开始时出现浅红棕色气体,用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深,产生上述现象的原因是
。(3)一段时间后,C中白色沉淀溶解,其原因是 。
(4)装置D的作用是 。
29、( 16分)类比是化学学习中常用的方法之一,已知硝酸能把铁氧化成 Fe ( NO3)3,但当铁过量时,产物是 Fe ( NO3 ) 2 。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 C12 足量时生成 FeC13 , 当铁粉过量时产物是 FeCl2。为验证该观点是否正确,该同学将一根细的纯铁丝分别在足量和少量的 C12 中点燃,取其表面生成物并分别编号为 A、B ,然后通过实验确定其成分。探究过程如下:
(1)提出假设: A 是 FeCl3, B 是 FeCl 2。
 (2)设计实验方案:分别取 A、B 的溶液均进行以下实验,但实验现象相同。请填写下表中的相应空格。 (2)设计实验方案:分别取 A、B 的溶液均进行以下实验,但实验现象相同。请填写下表中的相应空格。
(3)根据上述实验结论,写出 C12 与铁粉加热时发生反应的化学方程式:
(4)为进一步探究 FeC13 溶液的性质,他又利用 A 溶液做了如下一些实验,其中明显错误的是 。
A.将 A 溶液滴入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔现象
B.向 A 溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在 A 溶液中滴加 Na OH 浓溶液,出现红褐色沉淀
D.将 A 溶液加热蒸干并灼烧,得到 FeC13 固体
(5)实际应用:
FeCl3溶液常作印刷电路铜板腐蚀剂,腐蚀后的废液中含有 FeC13、FeCl2、CuCl2,某研究性学习小组的同学们设计了两种从废液中回收 Cu的方案:
方案1:向废液中加人过量的铁粉,充分反应后,过滤。在所得滤渣中加人足量的盐酸,充分反后,再过滤即得到铜。方案 1 中涉及的四种阳离子的氧化性由强到弱的顺序为:
方案2 :在废液中加入适量的盐酸调节溶液的 pH = 1 ,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的 Cu 已全部析出。方案 2 中铜作 极,该电极所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出)
方案 2 在电极上直接回收铜,操作上比方案 1 简便,但方案 2 也有不足之处,主要表现为:
。
第四次月考答案
第Ⅰ卷(客观题50分)
选择题(本题共25小题,每小题只有一个选项符合题意,共50分) |
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 | |
答案 |
A |
A |
A |
D |
B |
B |
D |
D |
C |
A | |
题号 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 | |
答案 |
A |
D |
B |
B |
D |
B |
C |
C |
B |
C | |
题号 |
21 |
22 |
23 |
24 |
25 |
|
|
|
|
| |
答案 |
C |
A |
C |
B |
C |
|
|
|
|
| |  (2)①③④…………………………………………………………(3分)
(2)①③④…………………………………………………………(3分)
 OH
OH