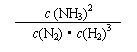推荐文章
- 化学计算专项训练三及答案
- 化学学科高考模拟试卷
- 化学反应速率和化学平衡
- 化学反应速率 化学平衡
- 化学元素及化合物所有化学方程式
- 08届高三化学第一学期期终考试模拟卷3
- 08届高三化学第一学期期中统一考试
- 08届高三化学第9月测试题
- 08届高三化学碱金属单元测试题1
- 08届高三化学电解质溶液专题练习
- 08届高三化学氧碳氮知识测试
- 08届高三化学暑期统一考试试题
08届高三化学复习选4模块复习测验
08届高三化学复习选4模块复习测验
(请在90min内完成)
第一部分选择题(共70分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1. 一个可逆的化学反应能否进行得完全,其根本因素是 ( )
A.温度 B.反应物的浓度
C.参加反应的各物质的性质 D.催化剂的加入
2. 关于化学平衡常数的叙述正确的是
A.一个化学反应的平衡常数是一个常数
B.两种物质反应,不管怎样书写化学方程式,平衡常数不变
C.温度一定时,对于给定的化学反应,正、逆反应的平衡常数互为倒数
D.浓度商Qc<Kc, ![]() 正 <
正 < ![]() 逆
逆
3. 根据热化学方程S ( s ) O2 ( g ) = SO2 ( g ) △H =-297.23 kJ/mol (反应在298K,101kPa下发生)分析下列说法不正确的是
A. 标况下,燃烧1mol S放出的热量为297.23 kJ
B. S ( g ) O2 ( g ) = SO2 ( g ) △H< —297.23 kJ/mol
C. 在密闭容器中1mol固态S 与1molO2 反应放出的热量小于297.23 kJ
D. 形成1 mol SO2 的化学键所释放的总能量大于断裂 1 molS ( s )和 1mol O2 ( g )的化学键所吸收的总能量
4. 将氨水滴加到盛有AgCl的试管中,AgCl逐渐溶解,对上述过程,下列叙述或解释中正确的有
A. 所得溶液中c(Ag )×c(Cl-)>Ksp(AgCl)
B. 所得溶液中形成了更难电离的物质
C. 上述实验说明Cl-与NH4+间有很强的结合力
D. 上述过程中NH3·H2O的电离程度增大
5. 某温度下,在容积固定不变的密闭容器中发生下列可逆反应:
X(g) 2Y(g) ![]() 2Z(g)
2Z(g)
平衡时,X、Y、Z的物质的量分别为1mol、1mol、2mol,保持温度不变,再向容器中分别充入1mol、1mol、2mol的X、Y、Z,则下列叙述中正确的是:
A.刚充入时,反应速率V正减小,V逆增大
B.达到新平衡时,容器内气体的百分组成和原来相同
C.达到新平衡时,容器内气体的压强是原来的两倍
D.达到新平衡时,容器内气体的密度是原来的两倍
6. 禽流感是禽流行性感冒的简称,它是一种由甲型流感病毒的一种亚型(也称禽流感病毒)引起的传染性疾病,被国际兽疫局定为甲类传染病。我国禽流感参考实验室确诊,湘潭县射埠镇湾塘村出现了H5N1亚型高致病性禽流感疫情,在疫区村民家里到处都洒满了石灰,甚至是低矮树木的叶子上都洒上了石灰,很是醒目。根据有关化学知识,判定下列说法不正确的是:
A.石灰之所以可以杀灭H5N1亚型高致病性禽流感病毒,是由于石灰与水产生的氢氧化钙显碱性,病毒为蛋白质,可以使蛋白质变性,而使病毒失去活性
B.饱和石灰水中加入生石灰,在温度不变的情况下,PH不变
C.饱和石灰水中加入生石灰,在温度不变的情况下,Ca2 的物质的量不变
D.给饱和石灰水溶液升高温度,c(OH-)的浓度降低
7. 、将0.1 L含有0.02mol CuSO4和0.01molNaCl的水溶液用惰性电极电解。电解一段时间后,一个电极上得到0.01 mol Cu,另一电极析出的气体
A.只有Cl2 B.只有O2 C.既有Cl2又有O2 D.只有H2
8. 下列说法或表示法正确的是: ﹙ ﹚
A.等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨) ![]() C(金刚石);ΔH= 11.9 kJ/ mol可知,金刚石比石墨稳定
C(金刚石);ΔH= 11.9 kJ/ mol可知,金刚石比石墨稳定
C.在稀溶液中:H (aq) OH-(aq)=H2O(l);ΔH=-57.3 kJ/ mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g) O2(g)=2H2O(l);ΔH= 285.8 kJ/ mol
9. 下列说法中,可以说明反应N2 3H2 ![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
A.1个N≡N键断裂的同时,有1个H—H键形成
B.1个N≡N键断裂的同时,有3个H—H键断裂
C.1个N≡N键断裂的同时,有6个N—H键断裂
D.1个N≡N键断裂的同时,有6个N—H键形成
10.工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为一放热反应。现将2mol SO2、1mol O2冲入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%,则下列热化学方程式正确的是:
A.2SO2(g) O2(g) ![]() 2SO3(g);△H = -196.6kJ·mol-1
2SO3(g);△H = -196.6kJ·mol-1
B.2SO2(g) O2(g) ![]() 2SO3(g);△H = -98.3kJ·mol-1
2SO3(g);△H = -98.3kJ·mol-1
C.SO2(g) 1/2O2(g) ![]() SO3(g);△H = 98.3kJ·mol-1
SO3(g);△H = 98.3kJ·mol-1
D.SO2(g) 1/2O2(g) ![]() SO3(g);△H = -196.6kJ·mol-1
SO3(g);△H = -196.6kJ·mol-1
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的4分,但只要选错一个,该小题就为0分)
11.关于C2H2(g) 5/2O2(g) == 2CO2(g) H2O(l) △H =-1300 kJ/mol的说法正确的是
A.10×6.02×1023电子转移时,该反应吸收1300 kJ的热量
B.1mol水的生成且为液体时,该反应放出1300 kJ的热量
C.有2×6.02×1023个碳氧共用电子对的生成,该反应放出1300 kJ的热量
D.有8×6.02×1023个碳氧共用电子对的生成,该反应放出1300 kJ的热量
12.室温下,pH相同体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
A. 加水稀释2倍后,两溶液的pH均减小
B. 使温度都升高20℃后,两溶液的pH均不变
C. 加适量的醋酸钠晶体后,两溶液的pH均增大
D. 加足量的锌充分反应后,醋酸产生的氢气比盐酸多
13.下列各组离子中,一定能大量共存的是:
A.加入铝粉有氢气产生的溶液中:Na 、SO4 ![]() 、C1-、K
、C1-、K
B.PH = 0的无色溶液中:Na 、K 、MnO4-、NO3-
C.在0.1mol/L的醋酸溶液中:Fe2 、Na 、ClO-、Ca2
D.在c(H )/c(OH-)= 1×1013的溶液中:NH4 、Ca2 、C1-、K
14.重水(D2O)的离子积C(D )•C(OD -)=1.6×10-15,可以用pH一样的定义来规定pD =--lg C(D )。下列关于pD的叙述正确的是( )
A.中性溶液pD=7
B.含0.01mol/LNaOD的D2O溶液1L pD=12
C.溶解0.01mol DCl的D2O溶液1L pD=2
D. 在100ml0.25mol/L的DCl重水溶液中,加入50ml0.2mol/L的NaOD重水溶液,pD=1.0
15.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:还原性Fe>Ni>Cu) ﹙ ﹚
A.阳极发生还原反应,其电极反应式:Ni2 2e— == Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2 和Zn2
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
16.已知0.1 mol / L 的二元酸H2A溶液的pH=4.0,则下列说法中正确的是
A. 在Na2A、NaHA两溶液中,离子种类不相同
B. 在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C. 在NaHA溶液中一定有:c(Na )+c(H )=c(HA-)+c(OH-)+2 c(A2-)
D. 在Na2A溶液中一定有:c(Na )>c(A2-)>c(H )>c(OH-)
17.已知25℃时,AgI饱和溶液中c (Ag )为1.22×10—8mol/L,AgCl的饱和溶液中c (Ag )为1.25×10—5mol/L。若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/LAgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确是
A.c (K )>c (NO3—) >c (Cl—) >c (Ag )>c (I—)
B. c (K )>c (NO3—) >c (Ag ) >c (Cl—)>c (I—)
C. c (NO3—)>c (K )>c (Ag ) >c (Cl—)>c (I—)
D. c (K )>c (NO3—) >c (Ag ) = c (Cl—) c (I—)
18.当电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是 ( )
A.当电池负极消耗mg气体时,电解池阳极同时有mg气体生成
B.电池的正极反应式为:O2 2H2O 4e— = 4OH-
C.电解后c(Na2CO3)不变,且溶液中有晶体析出
D.电池中c(KOH)变小,电池中溶液pH减小
19.锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为
负极反应:C6Li-xe-===C6Li1-x+xLi (C6Li表示锂原子嵌入石墨形成的复合材料)
正极反应:Li1-xMO2+xLi +x e-===LiMO2(LiMO2表示含锂的过渡金属氧化物)
下列有关说法正确的是
A.锂离子电池充电时电池反应为C6Li+Li1-xMO2===LiMO2+C6Li1-x
B.电池反应中,锂、锌、银、铅各失去1mol电子,金属锂所消耗的质量最小
C.锂离子电池放电时电池内部Li 向负极移动
D.锂离子电池充电时阴极反应为C6Li1-x+xLi +x e-===C6Li
20.已知反应:
![]() ①101Kpa时,2C(s) O2(g) 2CO(g);△H= -221 kJ/mol
①101Kpa时,2C(s) O2(g) 2CO(g);△H= -221 kJ/mol
![]() ②稀溶液中,H (aq) OH-(aq) H2O(1);△H= -57.3kJ/mol
②稀溶液中,H (aq) OH-(aq) H2O(1);△H= -57.3kJ/mol
下列结论正确的是
A.碳的燃烧热大于110.5 kJ/mol
B.①的反应热为221 kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
第二部分 非选择题(共80分)
21.(18分)(工业上合成氨是在一定条件下进行如下反应:N2(g) 3H2(g) ![]() 2NH3(g),△H = -92.44kJ/mol;其部分工艺流程如下:
2NH3(g),△H = -92.44kJ/mol;其部分工艺流程如下:
|
催化剂 高温、高压 |
|
N2、H2 |
|
氮气 |
|
氮气 |
|
混合气 |
|
产品 |
|
净化 |
|
循环气体 |
|
压缩 |
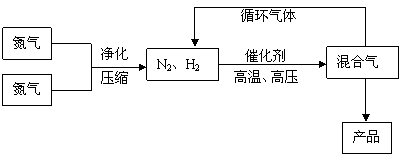 |
反应体系中各组分的部分性质见下表:
气体
氮气
氢气
氨
熔点(℃)
-210.01
-252.77
-77.74
沸点(℃)
-195.79
-259.23
-33.42