|
高三化学八校第一次联考试题
本试卷分第I卷 (选择题) 和第 = 1 \* ROMAN I = 2 \* ROMAN I卷 (非选择题) 两部分,共100分,考试时间100分钟。
第I卷(选择题 共42分)
一、 选择题 :本题包括 14 小题,每小题 3 分,共42分。第小题只有一个选项符合题意。
1. 下列叙述正确的是
‥ ‥
A. CO2 电子式是:∶O∶C∶O∶
¨ ¨
B. Ca原子的结构示意图为 
C.   聚丙烯的结构简式为:[CH2-CH2-CH2]n 聚丙烯的结构简式为:[CH2-CH2-CH2]n
D.在PCl3、CCl4 中各原子最外层均能达到 8 电子的稳定结构
2. 按如图装置进行电解实验,下列说法正确的是
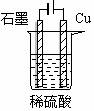
A. 电解过程中铜电极上有O2 产生
B. 整个电解过程中,溶液PH不断减小
C. 整个电解过程中,石墨电极上一直产生 H2
D.电解初期,主反应方程式为:Cu H2SO4  CuSO4 H2 ↑ CuSO4 H2 ↑
3. 下列离子一定能大量共存的是
A. 水溶液中:Na 、Al3 、Cl - 、HCO3-
B. 在PH = 1 的溶液中:Na 、Fe2 、Cl - 、NO3-
C. 在PH = 14的溶液中:K 、Cl-、ClO- 、Na
D.在含有大量Fe3 的溶液中:NH4 、K 、I - 、SO42-
4. 化学反应常伴随着颜色变化,下列有关反应获得的颜色不正确的是
 A.蛋白质遇浓硝酸 黄色 A.蛋白质遇浓硝酸 黄色
 B.溴化银见光分解 白色 B.溴化银见光分解 白色
 C.淀粉溶液遇单质碘 蓝色 C.淀粉溶液遇单质碘 蓝色
 D.氢气在氯气中燃烧时的火焰 苍白色 D.氢气在氯气中燃烧时的火焰 苍白色
5.下列说法正确的是
A.实验室保存少量液溴和白磷常用水封
B.不用其他试剂无法鉴别下列四种溶液:Na2CO3、Al2(SO4)3、NaCl、NaHSO4
C.可以用分液漏斗分离下列三组液态混合物:硝基苯和水;油酸和乙酸;乙酸乙酯和乙醇
D.CO2 中混有的少量HCl 杂质可以通入饱和 Na2CO3溶液中除去
6.下列过程或现象与盐类水解无关的是
A.浓硫化钠溶液有臭味
B.浓盐酸露置在空气中有白雾
C.向沸水中滴加饱和 FeCl3 溶液制取 Fe (OH)3 胶体
D.纯碱溶液去油污
7.人类生活离不开化学知识,下列叙述不正确的是
A.碘化银和干冰都可用于人工降雨
B.含铅汽油,含磷洗涤剂的使用均可对环境造成危害
C.医疗上常用体积分数为75%的酒精进行皮肤消毒
D.食品加工、消毒、防腐可使用福尔马林
8.设NA 为阿伏加德罗常数,下列说法正确的是
A.1mol Cl2 参加反应,反应过程中转移电子数都是2NA
B.6.8克熔融的KHSO4 中含有0.1NA 个阳离子
C.46克NO2 和N2O4混合气体中含有原子个数为3NA
D.标准状况下,11.2L三氯甲烷所含分子数为0.5 NA
9.下列离子方程式书写正确的是
A.次氯酸钠溶液中通入少量的SO2 气体:2ClO- SO2 H2O = SO32- 2HClO
B.向硝酸银溶液中滴加过量氨水:Ag NH3·H2O = AgOH ↓ NH4
C.向 Ca(HCO3)2 溶液中滴加过量NaOH 溶液:Ca2 2HCO3- 2OH- = CaCO3↓ CO32- 2H2O
D.氯化铝溶液与过量的氨水反应:Al3 4 NH3·H2O = AlO2- 4 NH4 2H2O
10.下列说法或表示方法正确的是
A.反应物总能量低于生成物总能量时,该反应不能发生
B.稀的强酸与稀的强碱反应放出的热量就是中和热
C.由C(石墨)(s)→C(金刚石)(s) ;△H > 0 可行,石墨比金刚石稳定
D.在101kPa ,25℃时,2克氢气完全燃烧生成液态水,放出285.5kJ的热量,氢气燃烧的热化学方程式表示为:2H2(g) O2 (g) = 2H2O (l) ;△H = -285.8 kJ/mol
11.下列说法正确的是
A.室温下0.1mol / L 的NaHCO3 溶液中,若 PH > 7,则 c(CO32- ) > c(H2CO3 )
B.相同条件下,等物质的量浓度的NH4Cl 和NH4 HSO4 溶液,前者溶液中NH4 浓度较小
C.在室温下,某溶液中由水电离出的c(H ) = 10-3 /L ,则此溶液可能是盐酸溶液
D.加水稀释醋酸溶液,溶液中所有离子浓度都会减小
12.以下是四种毒品的结构简式,下列有关说法不正确的是

A.这四种毒品都属于芳香族化合物
B.K粉的分子式为C13H12ClNO
C.1mol大麻最多可与含3mol Br2 的溴水发生反应
D.摇头丸在一定条件下可发生加成反应
13.下图表示不同温度(T)和压强(P)对可逆反应 2L (g)  2M(g) N(g) ;△H > 0 的影响情况,已知 P2 > P1 ,则图中纵轴表示的意义可能是 2M(g) N(g) ;△H > 0 的影响情况,已知 P2 > P1 ,则图中纵轴表示的意义可能是

= 1 \* GB3 ① 一定条件下L的转化率;
= 2 \* GB3 ②混合气体中M的百分含量;
= 3 \* GB3 ③混合气体中L的百分含量;
= 4 \* GB3 ④ 混合气体中的平均相对分子质量
A. = 1 \* GB3 ① = 2 \* GB3 ② B。 = 1 \* GB3 ① = 3 \* GB3 ③ C。 = 2 \* GB3 ② = 4 \* GB3 ④ D。 = 3 \* GB3 ③ = 4 \* GB3 ④
14.下列有关实验操作的叙述不正确的是
A.用干燥、洁净的玻璃棒醮取待测液滴在PH试纸(置于表面皿内)上测溶液的PH
B.烧瓶、锥形瓶、蒸发皿加热时都要垫石棉网
C.制备 Fe(OH)3胶体时,应往沸水中加饱和FeCl3 溶液,并继续加热至溶液呈红褐色为止
D.在中学“硫酸铜晶体里结晶水含量的测定”的实验中,至少需要进行四次称量操作
第 = 1 \* ROMAN I = 2 \* ROMAN I卷(非选择题 共58分)
15.(5分) 某化学反应的反应物和产物如下:
Al NaNO3 H2O → Al (OH)3 N2 NaAlO2
= 1 \* GB2 ⑴ 该反应的氧化剂是 。
= 2 \* GB2 ⑵ 该反应的氧化产物是 。
= 3 \* GB2 ⑶ 反应过程中转移 5mol e - ,生成标况下N2 的体积是 L。
= 4 \* GB2 ⑷ 配平该反应的化学方程式:
Al NaNO3 H2O → Al (OH)3 N2 NaAlO2
16.(5分) 甲、乙、丙、戊都具有如图所示的结构或结构单元。
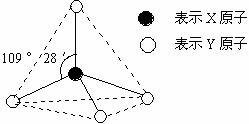
图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同。已知:
= 1 \* GB3 ①甲、乙是同一类晶体中的各自结构单元,单质甲能与乙发生置换反应
= 2 \* GB3 ②丙、丁、戊三种粒子含有等量的电子数,其中丙、丁是同一类晶体中的分子或分子集团
= 3 \* GB3 ③常温下丁呈液态,能产生两种等电子数的粒子
= 4 \* GB3 ④戊是阳离子
= 1 \* GB2 ⑴ 甲与乙发生置换反应的化学方程式是 。
= 2 \* GB2 ⑵ 写出液态丁产生两种等电子粒子的电离方程式 。
= 3 \* GB2 ⑶ 丙是目前重要的能源,丙和丁在催化、加热条件下得到两种可燃性的气体,其反应是化学方程式是 。
17.(11分) 已知A、B、C、D、E为五种短周期不同主族的元素,其原子序数依次递增。A、E两种原子最外层电子数之和是B原子最外层电子数的2倍;C、E两种原子最外层电子数之和是D原子最外层电子数的2倍。A、E形成的化合物分子甲中电子总数为18,D是地壳中含量最多的元素。回答下列的问题。
= 1 \* GB2 ⑴ 甲的电子式为 ,其分子为 分子(填“极性”或“非极性”)
= 2 \* GB2 ⑵ 工业生产E元素的单质的化学方程式为 。
= 3 \* GB2 ⑶ A 单质与C单质在一定条件下可化合为乙,工业生产乙的条件为 ,室温下,向PH = a 的乙的水溶液中加入等体积 PH = b 的甲的水溶液,且 a b = 14,充分作用后,溶液PH 7 (填“>”“<”或“=”),该溶液中各种离子浓度由大到小的顺序为 。
= 4 \* GB2 ⑷ C、D两元素可形成多种化合物,其中某一化合物含C元素质量分数为46.67%,写出该化合物的化学式 ,将它转化为C 的最高价含氧酸的化学方程式为
。
= 5 \* GB2 ⑸ A、B两元素也可形成多种化合物,其中分子量最小的分子为丙,则丙的空间构型为
。用D的单质和丙可以制成原电池,电池中装有浓KOH溶液,用多孔的惰性电极浸入浓KOH溶液中,在X极通入化合物丙,Y极通入D的单质,则X极是该电池的 极,X极的电极反应式为 。
18.(10分) 如图,常温下单质A、B为气体,单质C为固体,分别由短周期元素甲、乙、丙组成,甲元素原子核外电子数等于其电子层数,乙丙同主族,E常温下为液体,G、H为黑色固体,D是常见金属(反应条件多数略去)
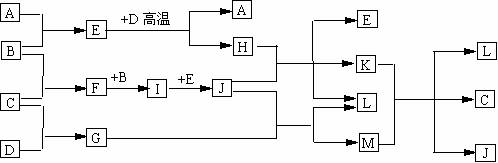
回答下列问题
= 1 \* GB2 ⑴ 化合物E、M的沸点 高(填化学式)原因是 。
= 2 \* GB2 ⑵ 甲、乙两种元素还可以形成一种含有4个原子核和18个电子的化合物,该化合物的结构式为 ;
= 3 \* GB2 ⑶ E 与 D高温反应的化学方程式为 ,
K 与 M 在水溶液中反应的离子方程式为 。
= 4 \* GB2 ⑷ 实验室在保存L溶液时,需加入少量D,理由是 ,
实验室检验L的水溶液中的阳离子的方法是 。
= 5 \* GB2 ⑸ 已知一定条件下每1mol F与单质B完全反应生成I放热98.0KJ,若2molF与1mol B在此条件下发生反应,达平衡时,放出热量为176.4KJ,则F的转化率是 ,平衡时F的物质的量为 ,若保持温度和压强不变(反应混合物都为气体)按下列四种配比作为起始物质充入,达到平衡时各物质的物质的量与上述平衡状态相同的是
A.4mol F 2mol B
B.2mol F 1mol B 2mol I
C.1mol F 0.5mol B 1mol I
D.3mol I 1mol Ne
19.(10分) 某化学爱好小组利用下图I = 2 \* ROMAN 探究铜和浓H2SO4 反应生成气体的性质,图 = 1 \* ROMAN II用来收集多瓶SO2 气体,请回答下列问题。

= 1 \* GB2 ⑴ 装置A中发生反应的化学方程式为 ;
= 2 \* GB2 ⑵ 分液漏斗中盛有液体,但打开分液漏斗的活塞时液体不能顺利流下,可能的原因是 ;
= 3 \* GB2 ⑶ 装置X的作用是贮存气体,X中广口瓶内应盛放的液体最好是 ;
= 1 \* GB3 ① Na2CO3 溶液 = 2 \* GB3 ② 酸性高锰酸钾 = 3 \* GB3 ③ Na2SO3 溶液 = 4 \* GB3 ④ 饱和NaHSO3 溶液
= 4 \* GB2 ⑷ 装置Y、Z 中产生的现象相同,但原因不同,Y 中是由于(写离子方程式)
而Z中则是由于SO2 具有 。
= 5 \* GB2 ⑸ 实验需要收集多瓶二氧化硫气体,在更换集气瓶时,为了减少二氧化硫逸散到空气中,将图I中的B部分更换为图 = 1 \* ROMAN II所示装置,可以用a、b 集气瓶交替收集二氧化硫气体,请回答:
= 1 \* GB3 ① 检查集气瓶b 是否漏气的方法是
。
= 2 \* GB3 ② 若只用集气瓶a 收集气体,在装置气密性良好,并加入药品后,预备制备并收集二氧化硫气体,下一步的操作是 ;
= 6 \* GB2 ⑹ = 1 \* GB3 ① 若用A装置作为实验室制取乙烯的发生装置,应对A装置作何改进?
= 2 \* GB3 ② 烧瓶中应加入碎瓷片,目的是 。
= 3 \* GB3 ③ 写出实验室制取乙烯的化学方程式 。
20.(10分) 有机物A (C8H16O2)可用作香皂、洗发香波等的芳香赋予剂,已知
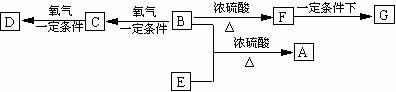
= 1 \* GB3 ① B分子中没有支链。
= 2 \* GB3 ② D能与碳酸氢钠溶液反应放出二氧化碳。
= 3 \* GB3 ③ D、E互为具有相同官能团的同分异构体。
= 4 \* GB3 ④ G为高分子化合物
= 1 \* GB2 ⑴ B可以发生的反应有 (选填序号)。
= 1 \* GB3 ① 取代反应 = 2 \* GB3 ② 消去反应 = 3 \* GB3 ③ 加聚反应 = 4 \* GB3 ④ 氧化反应
= 2 \* GB2 ⑵ E、F分子气含的官能团的名称依次是 、 。
= 3 \* GB2 ⑶ B与E反应的化学方程式为 。
= 4 \* GB2 ⑷ G 的结构简式为 ,它属于 型高分子化合物(填“线”或“体”)
= 5 \* GB2 ⑸ 写出两种符合下列条件的有机物的结构简式 = 1 \* GB3 ① 与D、E互为同分异构体 = 2 \* GB3 ② 能发生银镜反应 = 3 \* GB3 ③ 以发生消去反应; 、 。
21.(7分) 白色粉末A由Na2S、Na2SO3、Na2SO4和NaCl 等物质中的三种混合而成。取一定量A样品,投入 100mL 2.2 mol / L 盐酸中,充分反应后过滤,最终得到100 mL含H 的物质的量浓度为1 mol / L的滤液,若将此滤液蒸干,只得到8.19克纯净物B。
= 1 \* GB2 ⑴ A中是否有NaCl (填“有”或“没有”) ,理由是 。
= 2 \* GB2 ⑵ 若反应后还生成0.896L (标准状况下)气体,且该气体不会使品红褪色。求所取的样品A中含有Na2S的物质的量(已知:2S2- SO23- 6H = 3S↓ 3H2O)
参考答案:
1 2 3 4 5 6 7 8 9 10 11 12 13 14
D D C B A B D C C C B B A B
15.(5分) = 1 \* GB2 ⑴ NaNO3 (1分) = 2 \* GB2 ⑵ Al(OH)3、NaAlO2 (1分) = 3 \* GB2 ⑶ 11.2 (1分)
= 4 \* GB2 ⑷ 10,6,6,4,3,6 (2分)
16.(5分) = 1 \* GB2 ⑴ SiO2 2C  Si 2CO↑(2分) Si 2CO↑(2分)
= 2 \* GB2 ⑵ 2H2O  OH- H3O (1分) = 3 \* GB2 ⑶ CH4 H2O OH- H3O (1分) = 3 \* GB2 ⑶ CH4 H2O  CO 3H2 (2分) CO 3H2 (2分)
··
17.(每空1分,共11分) = 1 \* GB2 ⑴ H:Cl: (1分) 极性(1分)
= 2 \* GB2 ⑵ 2NaCl 2H2O  2NaOH H2↑ Cl2↑ (1分) 2NaOH H2↑ Cl2↑ (1分)
= 3 \* GB2 ⑶ 200~500atm ( 或20~50MPa),500℃左右催化剂 (1分) > (1分)
c(NH4 ) > c(Cl-) > c(OH-) >c(H ) (1分)
= 4 \* GB2 ⑷ NO (1分) 2NO O2 = NO2 3NO2 H2O = 2HNO3 NO
( 或 4NO 3O2 H2O = 4HNO3 ) (1分)
= 5 \* GB2 ⑸ 正四面体(1分) 负 (1分) CH4 – 8e- 10OH - = CO32- 7H2O (1分)
18.(每空1分,共10分)
= 1 \* GB2 ⑴ H2O (1分) 水分子间存在氢键 (1分)
= 2 \* GB2 ⑵ H-O-O-H (1分)
= 3 \* GB2 ⑶ 4 H2O 3Fe  Fe3O4 H2 (1分) 2Fe3 H2S = S ↓ 2Fe2 H (1分) Fe3O4 H2 (1分) 2Fe3 H2S = S ↓ 2Fe2 H (1分)
= 4 \* GB2 ⑷ 防止Fe2 被氧化成Fe3 。 (1分) 溶液中加KSCN溶液没现象,滴加氯水(或溴水)后变红(或滴加NaOH 溶液,先出现白色沉淀,后迅速转化为灰绿色,最后转化为红褐色)(1分)
= 5 \* GB2 ⑸ 90% (1分) 0.2mol (1分) C (1分)
19.(每空1分,共10分)
= 1 \* GB2 ⑴ Cu 2H2SO4 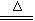 CuSO4 2H2O SO2 ↑ (1分) CuSO4 2H2O SO2 ↑ (1分)
= 2 \* GB2 ⑵ 分液漏斗上口的塞子未打开(或漏斗未与大气相通或漏斗塞子的凹槽未与颈部的通气孔对准(1分)
= 3 \* GB2 ⑶ = 4 \* GB3 ④ (1分)
= 4 \* GB2 ⑷ SO2 OH- = HSO3- (1分) 漂白性(1分)
= 5 \* GB2 ⑸ = 1 \* GB3 ① 关闭K2 ,在烧杯中用水封住玻璃导管口,用手捂住集气瓶b,烧杯中导管口有气泡产生,松手后,导管内有一段液柱保持不降则气密性好(1分)
= 2 \* GB3 ② 打开K1,关闭K2,点燃酒精灯。 (1分)
= 6 \* GB2 ⑹ = 1 \* GB3 ① 将分液漏斗换成量程不低于200℃的温度计(1分) = 2 \* GB3 ② 防止暴沸(1分)
= 3 \* GB3 ③ 
20.( 10分)
= 1 \* GB2 ⑴ = 1 \* GB3 ① = 2 \* GB3 ② = 4 \* GB3 ④ (1分)
= 2 \* GB2 ⑵ 羧基 碳碳双键 ( 各1分)
= 3 \* GB2 ⑶ 
= 4 \* GB2 ⑷

= 5 \* GB2 ⑸
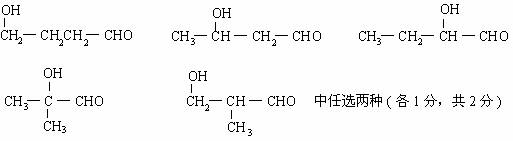
21. = 1 \* GB2 ⑴ 有(1分);由于消耗盐酸 n (HCl ) = 0.1× 2.2 -0.1× 1 = 0.12 mol ,则反应生成的NaCl 质量为0.12×58.5 = 7.02克 < 8.19克,因而A中含有NaCl (2分)
= 2 \* GB2 ⑵ 0.053 mol (4分)
|