| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
回答下列问题: (3)上述实验中的“待测数据”指_____________; (4)本实验装置图中量气装置B由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是___________(填“酸式”或“碱式”)滴定管; (5)若要证实实验⑤中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞,______________________ (6)为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作): a._______________________________,b.CuO的化学性质有没有改变。 21.(10分)实验室用50 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液在下图装置中进行中和反应,并通过测定反应过程中所放 出的热量来计算中和热。试回答下列问题: (2) (填“能”或“不能”)将环形玻璃搅拌棒 改为环形金属(如铜)棒。其原因是 。
是 (填“偏高”或“偏低”或“无影响”)。 (4)假如改用60 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1 氢氧化钠溶液进行反应,则与上述实验相比,所放热量 (“增加”、 “减少”或“不变”),理由是 ; 所求中和热数值 (“增加”、 “减少”或“不变”), 理由是 。 四、(本题包括2小题,共20分) 22.(8分)在一个固定体积的密闭容器中,向容器中充入2 mol A和1 mol B,发生如下反应:2A(g) B(g) (1)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为________(填“吸热”或“放热”)反应。 (2)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是_________(用序号填空) ①4 mol A 2 mol B ②3mol C 1 mol D l mol B ③3 mol C 2 mol D ④1.6 mol A 0.8 mol B 0.6 mol C (3)某温度下,向容器中加入3 mol C和0.8 mo1 D,反应达到平衡时C的浓度仍为1.2 mol/L,则容器的容积V应大于_________L,小于________L。 23.(12分) 生产重铬酸钠的专业厂是用铬铁矿(主要成分是Cr2O3.FeO,还有一定量的Al2O3等)为原料的,其生产过程如下: (1)Cr元素所在周期表中的位置 (2)在特制熔炉中将铬铁矿和过量纯碱混合,在1100℃左右通空气进行氧化:Cr2O3发生反应的化学方程式: Cr2O3 Na2CO3 O2 == Na2CrO4 CO2↑ Al2O3发生反应的化学方程式: 。 (3)经上述过程后的反应料(称熟料),冷却后用水浸取,其中可溶性的物质主要有 ,不溶性杂质经过滤后除去。 (4)为了除去滤液中的铝元素,用稀硫酸将溶液中和至PH为7—8,其反应的离子方程式为 。 (5)除去铝元素后的滤液,再用稀硫酸调到PH为2—3,这时可得Na2Cr2O7溶液,其反应方程式为: Na2CrO4 H2SO4 —— (6)请简述在实验室中可通过哪些操作可除去溶液中所混有的硫酸钠晶体,从而得到较纯的重铬酸钠溶液。(已知硫酸钠的溶解度随温度的变化较大,而重铬酸钠变化较小。)
五、(本题包括2小题,共19分) 24、(9分)在有机物分子中,若碳原子连接四个不同的原子或原子团,该碳原子称为不对称碳原子(或手性碳原子)。具有手性碳原子的有机物具有光学活性。八角属于草本植物,主要产于中国和越南,是我国民间常用做烹调的香料。最新医学研究成果显示,从八角中可以提取到莽草酸,它是一种白色晶体,微溶于水,是制取抗禽流感药的基本原料。莽草酸的结构式如下:
请回答下列问题: (1)写出莽草酸分子中任意两个官能团名称:_____________、_______________。 (2)该有机物分子中含________个手性碳原子。试设计一步反应使其生成具有2个手性碳原子的物质,其化学方程式为:_____________________。 (3)该有机物分子1moL最多能和 moLNaOH发生反应。 25、(10分)1912年的诺贝尔化学奖授予法国化学家V.Grignard,用于表彰他所发明的Grignard试剂(卤代烃基镁)广泛运用于有机合成中的巨大贡献。Grignard试剂的合成方法是:RX+Mg
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,该物质具有一定对称性。合成线路如下:
请按要求填空: (1)3,4-二甲基-3-己醇是: (填代号),E的结构简式是 ; (2)C→E的反应类型是 ,F→G的反应类型是 ; (3)写出下列化学反应方程式(有机物请用结构简式表示): A→B , I→J 。 六、(本题包括2小题,共20分) 26、(8分)化合物A含硫(每个分子只含一个硫原子)、氧以及一种卤素。少量A与水反应完全水解但不发生氧化或还原,所有反应产物均可溶于水。将A配成水溶液稀释后分成几份,分别加入一系列0.1mol/L的试剂,现象如下: ①加入硝酸酸化的硝酸银,产生白色沉淀; ②加入氯化钡溶液,无沉淀产生; ③溶液经酸化后加入高锰酸钾溶液,紫色褪去,再加入硝酸钡溶液,产生白色沉淀。 (1)由此判定组成该化合物的元素中,可能存在的卤素有 ,A与水反应后生成的溶液中含有的离子可能有 。 (2)要确定该化合物的分子式,称取11.90gA溶于水稀释至250.00mL,取25.00mL溶液加入足量的高锰酸钾和硝酸钡溶液,使沉淀完全,沉淀经洗涤、干燥后称重为2.33g。试确定A的化学式,写出计算推理过程。 27、(12分)某研究性学习小组拟用铜屑与氧化铜混合物与硫酸和硝酸组成的混酸反应来制取CuSO4·5H2O晶体,混酸中硝酸的还原产物为NO,反应过程中不产生SO2,反应后的溶液中不含Cu(NO3)2, 反应中固体完全溶解,两种酸均恰好完全反应。设固体混合物的总质量为480 g,其中铜屑的质量分数为x,试回答下列。 (1)所得硫酸铜晶体的质量y为: g(用x表示); (2)若x =0.4,混酸中HNO3与H2SO4的物质的量之比为: ; (3)若x =0.4,480g固体混合物与一定量混酸微热后,充分反应,冷却恰好只得到CuSO4·5H2O,试求原混酸中H2SO4的质量分数。 化学科试题参考答案及评分标准
| 题号
| 1
| 2
| 3
| 4
| 5
| 6
| 7
| 8
| 9
|
| 答案
| D
| B
| C
| B
| C
| C
| D
| A
| D
|
| 题号
| 10
| 11
| 12
| 13
| 14
| 15
| 16
| 17
| 18
| 19
| 答案
| AB
| BD
| C
| BC
| D
| AB
| BC
| CD
| D
| A |
20. (14分) (1) ①②③ 研钵
(2)沿玻璃棒向过滤器中的沉淀上加蒸馏水至沉没沉淀,静置使其全部滤出,重复2~3次
(3)时间
(4)碱式
(5)取一根带火星的木条,伸入干燥管内,看木条是否复燃
(6)CuO的质量有没有改变 (每空2分,共14分)
21.(10分)(1)减少实验过程中的热量损失(1分)
(2)不能(1分) ; 因金属易导热(1分)
(3)偏低(1分)
(4)增加(1分);后者生成0.055mol的H2O,而前者只能生成0.050mol的H2O(2分);
不变(1分);“中和热”是指酸跟碱发生中和反应生成1摩尔H2O时所放出的热量,与酸碱的用量无关 (2分)
22.(8分)(1)吸热 (2)③ (3)0.5 2.5 (每空2分,共8分)
23.(12分)(1) 第四面期第VIB族(2分)
(2) 2 Cr2O3 4 Na2CO3 3 O2 == 4 Na2CrO4 4 CO2↑(2分)
Al2O3 Na2CO3 == 2NaAlO2 CO2↑(1分)
(3)Na2CO3、Na2CrO4、NaAlO2 (1分)
(4)AlO2- H H2O == Al(OH)3(1分)CO32- 2 H == CO2↑ H2O(1分)
(5)2 Na2CrO4 H2SO4 == Na2Cr2O7 Na2SO4 H2O (2分)
(6)加热、浓缩、冷却、结晶、过滤 (2分)
24、(9分)(1)羧基、羟基等。(每个1分,共2分)(2)3个(2分),加成或脱氢均可以。(3分)(3)1moL(2分)
|
H2 |
|
催化剂 |
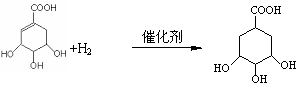 |
|
浓硫酸 |
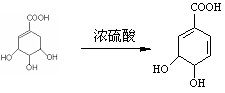 或:
或:
|
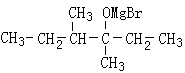 25、(10分)
25、(10分)
(1)F (2分) (2分)
(2)加成反应(1分) 消去反应(1分)
(3)CH3CH2CHBrCH3+NaOH ![]() CH3CH2CH(OH)CH3+NaBr(2分)
CH3CH2CH(OH)CH3+NaBr(2分)
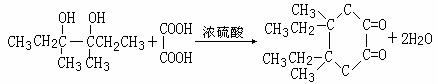 (2分
(2分
26.(8分)
解析:此题为计算推断题
(1)Cl(1分)、 H 、SO32-、HSO3-、Cl-、(少量OH-)(2分)。
(2)11.90g A中含硫2.33g/233g/mol×10=0.1mol,M(A)=11.90g/0.1mol=119g/mol
A中硫呈 4价且只含一个硫原子,故A分子中只含一个氧原子和2个卤原子,两个卤原子的式量为119-32-16=71,只能是2个氯原子,A的化学式为SOCl2(5分)
27. (12分)
(1)375x 1500 (4分)
(2)1∶3.3 (4分)
(3)(4分)

| |