| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
9.一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应: 2X(g)+Y(g) A.若增大压强,则物质Y的转化率减小 B.将容器体积变为20 L,Z的平衡浓度变为原来的 C.以X浓度变化表示的反应速率为0.001mol/(L·S) D.若升高温度,X的体积分数增大,则该反应的△H>0 10.从海水中提取镁,可按如下步骤进行: ①把贝壳制成石灰乳; ②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物; ③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物; ④将得到的产物熔融电解得到镁。下列说法不正确的是 A.此法的优点之一是原料来源丰富 B.①②③步骤的目的是从海水中提取MgCl2 C.以上提取镁的过程中涉及化合、分解和复分解反应 D.第④步电解时阴极产生氯气
二.不定项选择题(本题包括9小题,每小题3分,共27分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项, 只选一个且正确的得1分,选两个且都正确的得满分,但只要选错一个该小题就为0分) 11.在解释物质性质变化规律与物质结构间的因果关系时,与键能无关的变化规律是 A.F2、Cl2、Br2、I2的沸点逐渐升高 B.与硅相比,金刚石的硬度大,熔点高 C.HF、HCl、HBr、HI热稳定性依次减弱 D.H2、O2、H2S在水中的溶解性依次为难溶、微溶、可溶 12.下列各溶液中,各离子可能大量共存的有 A.含有大量Ba2+的溶液中:HCO3-、Fe3+、Ag+、SO42-、SCN- B.滴加无色酚酞试液后仍无色的溶液中:Na+、CO32-、K+、ClO-、AlO2- C.由水电离的c(OH-)=10-14mol·L-1 的溶液中:CH3COO-、C6H5O-、Na+、K+ D.加入铝粉后产生氢气的溶液中:NH4+、Na+、NO3-、Cl-、HS- 13.锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一。从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原: 2Sb2S3+3O2+6Fe=Sb4O6+6FeS ……………………① Sb4O6+6C=4Sb+6CO ………………………………② 关于反应①、反应②的说法正确的是 A. 反应①②中的氧化剂分别是Sb2S3、Sb4O6 B.反应①中每生成3 mol FeS时,共转移6 mol电子 C.反应②说明高温下Sb的还原性比C强 D.每生成4 mol Sb时,反应①与反应②中还原剂的物质的量之比为4︰3 14.下列离子方程式书写正确的是 A.用大理石与盐酸制取CO2:CO32-+2H+ B.苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- C.澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2HCO3- D.硝酸亚铁溶液中滴加盐酸:3Fe2++4H++NO3-
A.M既能与FeCl3发生反应,也能与CH3COOH发生反应 B.M与Br2只能发生取代反应,不能发生加成反应 C.M可溶于NaOH稀溶液,1molM最多消耗3mol NaOH D.1molM在催化剂作用下最多能与4molH2发生加成反应
A.磷化硼晶体的化学式为BP,属于离子晶体 B.磷化硼晶体的熔点高,且熔融状态下能导电
D.磷化硼晶体结构微粒的空间堆积方式与氯化钠相同 17.如右图所示,a、b是多孔石墨电极,某同学按图示装置进行如下 实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是 A.断开K2,闭合K1一段时间,溶液的pH要变大 B.断开K1,闭合K2时,b极上的电极反应式为: 2H++2e-=== H2↑ C.断开K2,闭合K1时,a极上的电极反应式为:4OH-―4e-=== O2↑十2H2O D.断开K1,闭合K2时,OH-向b极移动 18.常温下,下列各溶液的叙述中正确的是 A.0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后溶液显酸性 c (Ac-)>c (Cl-)>c (H+)>c (HAc) B.pH=7的醋酸钠和醋酸混合液中:c(Na+)= c(CH3COO-) C.0.1mol/L的醋酸的pH=a,0.01mol/L的醋酸的pH=b,则a+1>b D.已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中, [c(Na+)-c(F-)]< [c(K+)-c(CH3COO-)] 19.现有100 mL 溶质为MgCl2和AlCl3的混合溶液,其中c(Cl-)=1.0 mol·L-1,c(Mg2+)=0.2mol·L-1。若不考虑水解因素,则要使其中的Mg2+全部转化为Mg(OH)2沉淀而分离出来,至少需要4mol·L-1的NaOH溶液的体积是 A.25mL B.5mL C.30mL D.100mL 08届高三化学上册质量检测试卷 第Ⅱ卷(非选择题,共63分) 三.(本题包括2小题,共22分) 20.(12分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3+CO2+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号)。 a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解 c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出 (2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。 ① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
试回答下列有关问题:
a.加成反应 b.取代反应 c.消去反应 d.水解反应 e.银镜反应
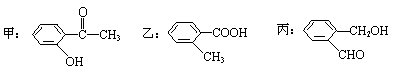
(2)今有化合物 ①请写出丙中含氧官能团的名称: ; ②请判别上述哪些化合物互为同分异构体: ; ③请按酸性由强至弱排列甲、乙、丙的顺序: ; (3)由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。
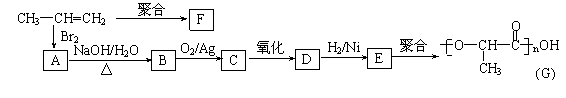
①丙烯分子中,最多有 个原子在同一个平面上; ②聚合物F的结构简式: ; ③B转化为C的化学方程式: ; ④在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式: 。
五.(本题包括1小题,共10分) 25.(10分)氯化钙是用途广泛的化学试剂,可作干燥剂、冷冻剂、防冻剂等。为了测定某氯化钙样品中钙的含量,进行如下实验: = 1 \* GB3 ①准确称取氯化钙样品0.2312 g,放入烧杯中,加入适量6 mol/L的盐酸和适量蒸馏水使样品完全溶解,再滴加35 mL 0.25 mol/L (NH4)2C2O4溶液,水浴加热,逐渐生成CaC2O4沉淀,经检验,Ca2+已沉淀完全。 = 2 \* GB3 ②过滤并洗涤 = 1 \* GB3 ①所得沉淀。 = 3 \* GB3 ③加入足量的10% H2SO4和适量的蒸馏水, = 2 \* GB3 ②中沉淀完全溶解,溶液呈酸性,加热至75℃,趁热加入0.05 mol/L KMnO4溶液16 mL,恰好完全反应。 回答下列问题: (1)配平: MnO4-+ H2C2O4+ H+― Mn2++ CO2↑+ H2O (2)0.05mol·L-1KMnO4标准溶液应置于 (选填“酸式”或“碱式”)滴定管中;判定滴定终点的现象为 。 (3)计算该氯化钙样品中钙元素的质量分数(精确到0.01%)。
试题到此结束,请认真检查。
答 题 卡
| 题 号
| 三
| 四
| 五
| 第II卷总分
| 得 分
|
|
|
|
| 评卷人
|
|
|
| 复核人
|
|
| |
请在各题规定的黑色矩形区域内答题,超出该区域的答案无效!
一、二选择题请用2B铅笔填写在答题卡上。
三、(本题包括2小题,共22分)
20.(12分)
(1)析出碳酸氢钠晶体的原因是 (填字母标号)。
![]() (2)(Ⅰ) ;(Ⅱ) ;
(2)(Ⅰ) ;(Ⅱ) ;
(Ⅲ)分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
(Ⅰ)须先从 管通入 气体,再从 管中通入 气体;
(Ⅱ)理由是 ;
(3) 。
21.(10分)
(1)G的化学式为 ; (2)A的电子式为 ;
(3)反应②的离子方程式: ;
(4)反应④的离子方程式: ;
(5)反应①的热化学方程式为: 。
四、(本题包括3小题,共31分)
22.(13分)
(1)最外层电子层上只有两个电子的是________________(填“元素符号”);
(2)下列叙述正确的是_____________(填字母序号);
(3)DA4+离子的空间构型 ,ME2的空间构型 ;
(4) 晶体(填晶体类型); 结构图:
(5)化学式为 ,配位体为 。
23.(8分)
(1)K= ,K值 (填“增大”、“减小”或“不变”);
 (2)v(H2)= ;
(2)v(H2)= ;
(3)下列有关该体系的说法正确的是 (填字母序号)。
请在各题规定的黑色矩形区域内答题,超出该区域的答案无效!
请在各题规定的黑色矩形区域内答题,超出该区域的答案无效!
24.(10分)
(1) (填字母序号);
(2)① ; ② ; ③ ;
(3)① ; ② ;
③B转化为C的化学方程式: ;
④该化合物的结构简式: 。
五、(本题包括1小题,共10分)
25.(10分)
(1)配平: MnO4-+ H2C2O4+ H+― Mn2++ CO2↑+ H2O
(2)置于 (选填“酸式”或“碱式”)滴定管中;判定滴定终点的现象为 ;
(3)计算该氯化钙样品中钙元素的质量分数(精确到0.01%,写出计算过程)。
请在各题规定的黑色矩形区域内答题,超出该区域的答案无效!
参考答案
一、二选择题:
题号
1
2
3
4
5
6
7
8
9
10
答案
B
C
D
C
B
A
C
A
C
D
题号
11
12
13
14
15
16
17
18
19
![]()
答案
AD
C
B
BD
AC
C
B
BC
C
三、(本题包括2小题,共22分)
20.(12分) (1)c (1分)
(2)①(Ⅰ)饱和碳酸氢钠溶液; (Ⅱ)吸收未反应的NH3(答“防止倒吸”或“吸收CO2”不给分));
(Ⅲ)过滤 (每空1分,共3分)
②(Ⅰ)a、NH3, b、CO2; (每空1分,共4分)
(Ⅱ)增大气体与溶液接触面积,提高CO2吸收率; (2分)
|
‥ |
|
‥ |
|
‥ |
|
‥ |
|
Fe2+[∶S∶S∶]2- |
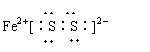 (3)用碳酸氢铵与适量饱和食盐水反应。(或往烧碱溶液中通入过量CO2 ;往饱和Na2CO3 溶液中通入过量CO2 等。其他合理方法均可) (2分)
(3)用碳酸氢铵与适量饱和食盐水反应。(或往烧碱溶液中通入过量CO2 ;往饱和Na2CO3 溶液中通入过量CO2 等。其他合理方法均可) (2分)
21.(10分) (1)SO3 (1分) (2) (2分)
(3)2Na2O2+2H2O 4Na++4OH-+O2↑ (2分) (4)Fe2O3+6H+ 2Fe3++3H2O (2分)
 (5)FeS2(s)+11/4O2(g)
(5)FeS2(s)+11/4O2(g) 1/2 Fe2O3(s)+2SO2(g);△H=-852 kJ/mol (3分)
四、(本题包括3小题,共31分)
22.(13分) (1)He、Be、Fe (2分) (2)a、c、d (2分)
(3)正四面体型、直线型 (2分) (4)离子晶体 (1分) 结构图 (2分)
(5)绿色晶体的化学式是[TiCl(H2O)5]Cl2·H2O(2分); H2O、Cl-(2分)
23.(8分) (1)K=c(CH3OH)/c(CO)·c2(H2) (3分) 减小 (1分)
(2)2nB/3tBmol·(L·min)-1 (2分) (3) b、c (2分)
24.(10分)
(1)c、e (1分) (2)①醛基、羟基(1分) ②甲 乙 丙(1分) ③乙>甲>丙(1分)
|
—CH—CH2—n |
|
CH3 |
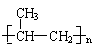 |
(3)① 7 (1分) ② (1分)
|
Ag △ |
|
CH2OH |
|
CH2OH |
|
O2 |
|
2H2O |
|
CHO |
|
CHO |
|
CH—CH3 |
|
CH3—CH |
|
COO |
|
OOC |
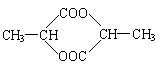 ③ (2分)
③ (2分)
④ (2分)
五、(本题包括1小题,共10分)
25.(10分)
(1)2、5、6、2、10、8 (3分)
(2)酸式、当看到滴入1滴KMnO4溶液时,锥形瓶中溶液立即变成紫红色,且半分钟内不褪色,即达到滴定终点。(3分) (3)34.60% (4分)
| |