| |
|
[组图]高三基本概念基本理论专题测试卷
|
| 查询化高三上复习的详细结果
|
|
当前位置: :首页 > 化学试题 > 高三化学试题 > 正文
推荐文章
- 化学计算专项训练三及答案
- 化学学科高考模拟试卷
- 化学反应速率和化学平衡
- 化学反应速率 化学平衡
- 化学元素及化合物所有化学方程式
- 08届高三化学第一学期期终考试模拟卷3
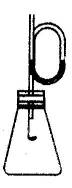
- 08届高三化学第一学期期中统一考试
- 08届高三化学第9月测试题
- 08届高三化学碱金属单元测试题1
- 08届高三化学电解质溶液专题练习
- 08届高三化学氧碳氮知识测试
- 08届高三化学暑期统一考试试题
08届高三化学基本概念基本理论专题测试卷
2008届高三基本概念基本理论专题测试卷
可能用到的相对原子质量:H—1 C—12 O—16 P-31
一、选择题(每小题只有一个选项符合题意,每小题3分,共30分)
1. 2007年3月21日,我国公布了111号元素Rg的中文名称。该元素名称及所在周期:
A.钅仑 第七周期 B.镭 第七周期 C.铼 第六周期 D.氡 第六周期
2.请你运用所学的化学知识判定,下列有关化学观念的叙述错误的是
A 几千万年前地球上一条恐龙体内的某个原子可能在你的身体里
B 用斧头将木块一劈为二,在这个过程中个别原子恰好分成更小微粒
C 一定条件下,金属钠可以成为绝缘体
D 一定条件下,水在20℃时能凝固成固体
3.下列离子方程式书写正确的是( )
A.实验室用消石灰和氯化铵加热制氨气 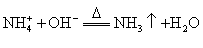
B.磷酸二氢钾溶液中加入足量的氢氧化钡 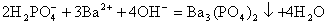
C.硝酸亚铁溶液中滴入HF酸溶液 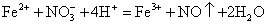
D. 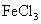 溶液与 溶液与 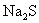 溶液反应 溶液反应 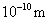
4. 有关晶体的下列说法中正确的是 ( )
A 晶体中分子间作用力越大,分子越稳定 B 原子晶体中共价键越强,熔点越高
C 冰融化时水分子中共价键发生断裂 D 氯化钠熔化时离子键未被破坏
5.已知下列元素的半径为: |
原子 |
N |
S |
O |
Si | |
半径r/ 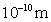 |
0.75 |
1.02 |
0.74 |
1.17 | |
根据以上数据,磷原子的半径可能是( )
A.0.80× 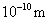 B.1.10× B.1.10× 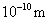 C.1.20× C.1.20× 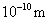 D.0.70× D.0.70× 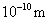
6.最近科学研究表明,用氯气杀灭自来水中的病菌并非良好方法,氯胺( 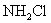 )在中性或酸性条件下是一种更好的强消毒剂,氯胺的消毒原理之一是( ) )在中性或酸性条件下是一种更好的强消毒剂,氯胺的消毒原理之一是( )
A. 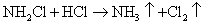 B. B. 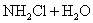 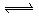 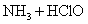
C. 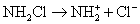 D. D. 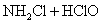 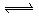 
7.从海水中提取溴有如下反应: 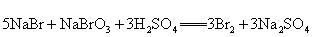
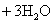 ,与上述反应在氧化还原原理上最相似的是( ) ,与上述反应在氧化还原原理上最相似的是( )
A. 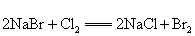 B. B. 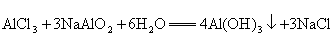
C. 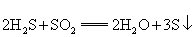 D. D. 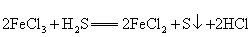
8. 对相同状况下的12C18O和14N2两种气体,下列说法正确的是
A.若质量相等,则质子数相等 B.若原子数相等,则中子数相等
C.若分子数相等,则体积相等 D.若体积相等,则密度相等
 9.一定温度下,向一个一定容积的密闭容器中放入2molX和3molY,发生如下反应:X(g) Y(g) mZ(g) nR(g),达到平衡时Z的体积分数为 9.一定温度下,向一个一定容积的密闭容器中放入2molX和3molY,发生如下反应:X(g) Y(g) mZ(g) nR(g),达到平衡时Z的体积分数为  ,维持温度不变,若把3molX和2molY放入另一体积相同定容的密闭容器,达平衡时,Z的体积分数为 ,维持温度不变,若把3molX和2molY放入另一体积相同定容的密闭容器,达平衡时,Z的体积分数为  ,则 ,则 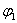 和 和 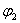 关系为( ) 关系为( )
A. 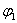 < < 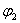 B. B. 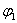 > > 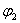 C. C. 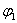 = = 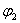 D.无法判定 D.无法判定
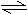 10. 在aL的密闭容器里,于一定温度进行2A(气) B(气) 2C(气)的可逆反应。容器内开始加入下列各组物质,在达到平衡时逆反应速率最大的一组物质是( ) 10. 在aL的密闭容器里,于一定温度进行2A(气) B(气) 2C(气)的可逆反应。容器内开始加入下列各组物质,在达到平衡时逆反应速率最大的一组物质是( )
A.2molA和1molB B.1molA和1molB C.1molA和2molB D.1molB和1molC
二、选择题(每小题有1-2个选项符合题意,每小题4分,共40分)
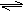 11.可逆反应2SO2+O2 2SO3,正反应速率分别用v表示,逆反应速率用v¢表示,速率单位为mol/(L·min).当反应达到化学平衡时,正确的关系是( ) 11.可逆反应2SO2+O2 2SO3,正反应速率分别用v表示,逆反应速率用v¢表示,速率单位为mol/(L·min).当反应达到化学平衡时,正确的关系是( )
A.V(SO3)=V¢(SO3) B.V(O2)=V(SO2)=V(SO3) C.V(O2)= 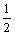 V¢(SO2) D.V¢(SO2)=V¢(SO3)=V¢(O2) V¢(SO2) D.V¢(SO2)=V¢(SO3)=V¢(O2)
12.关于合成氨工业,下列说法正确的是( )
A.合成氨的反应是放热的,所以合成氨时温度越低,对氨的工业生产越有利。
B.根据合成氨,增大压强能提高氨的生产率,所以在合成氨工业中在条件答应的情况下应尽量增大压强。
C.生产中常使用某种廉价易得的原料适当过量,以提高另一原料的转化率。
D.使用催化剂只加快反应速度,不影响平衡移动,因此对合成氨产量无影响。
13.设NA为阿佛加德罗常数,下列叙述中正确的是( )
A 18 g D2O中含有的质子数目为10NA B 标准状况下22.4 L H2 中含中子数为2 NA
C 1molH2O2 在二氧化锰的作用下完全分解,电子转移数为2 NA
D 14g乙烯和丙烯的混合物中总原子数为3 NA个
14.下列各组物质的性质比较中,正确的是( )
A.热稳定性:PH3<SiH4<NH3<HF B.微粒直径大小:S2->Cl->Mg2 >Al3
C.酸性强弱:盐酸>乙酸>碳酸>次氯酸 D.熔点高低:石墨>食盐>干冰>液溴
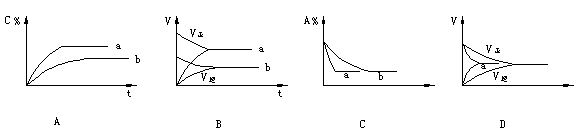  15.气态反应A+B C+D,其它条件不变,在有催化剂条件(a)时和无催化剂条件(b)时的反应过程中,有关的量(纵坐标)随时间(横坐标)的变化情况错误的是( ) 15.气态反应A+B C+D,其它条件不变,在有催化剂条件(a)时和无催化剂条件(b)时的反应过程中,有关的量(纵坐标)随时间(横坐标)的变化情况错误的是( )
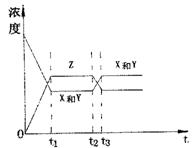
 16.今有反应X(g) Y(g) 2Z(g) △H<0若反应 16.今有反应X(g) Y(g) 2Z(g) △H<0若反应
开始经t1秒后达到平衡,又经t2秒后,由于反应条件的
改变使平衡破坏,则t3时又达到平衡,如图表示,试分
析,以t2到t3秒曲线变化的原因是( )
A.增大了X和Y的浓度
B.使用了催化剂
C.增加了反就体系的压强
D.升高了反应的温度
17.下列关于元素的叙述正确的是
A.金属元素与非金属元素能形成共价化合物
B.只有在原子中,质子数才与核外电子数相等
C.目前使用的元素周期表中,最长的周期含有36种元素
D.非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
18.下列指定微粒的个数比为2∶1的是 ( )
A Be2 离子中的质子和电子 B 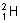 原子中的中子和质子 原子中的中子和质子
C Na2CO3溶液中的阳离子和阴离子 D BaO2(过氧化钡)固体中的阴离子和阳离子
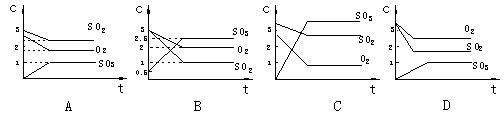
 19.有关2SO2+O2 2SO3反应的下列图象正确的是( ) 19.有关2SO2+O2 2SO3反应的下列图象正确的是( )
20.一定温度下可逆反应:A(s) 2B(g)  2C(g) D(g);△H<0。现将1mol A和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是 2C(g) D(g);△H<0。现将1mol A和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
A.保持温度和活塞位置不变,在甲中再加入1molA和2molB,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增大
C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
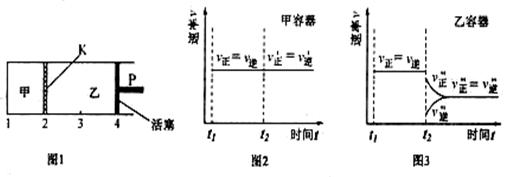 D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
 第Ⅱ卷(非选择题 共80分) 第Ⅱ卷(非选择题 共80分)
三、(本题包括3小题,共33分)
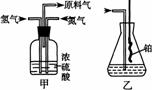
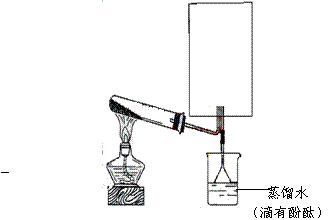
21.(13分)实验室模拟合成氨和氨催化氧化的流程如下:
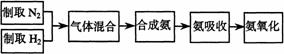
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
 (1)从右图中选择制取气体的合适装置:氮气 、氢气 (1)从右图中选择制取气体的合适装置:氮气 、氢气
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有 、
(3)氨合成器出来经冷却的气体连续通人乙装置的水中吸收氨,
(“会”或“不会”)发生倒吸,原因是: 。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是: ,锥形瓶中还可观察到的现象是: 。
(5)写出乙装置中氨氧化的化学方程式:
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、 、 离子。
22.(12分)短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):

已知a.常见双原子单质分子中,X分子含共价键最多。b.甲分子中含10个电子,乙分子含有18个电子。
(1)X的电子式是 。
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。
①在图中方框内绘出用烧瓶收集甲的仪器装置简图。
②试管中的试剂是(填写化学式) 。
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示) 。
(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是 。
(4)n mol丁与n mol丙在一定条件下反应,生成4n mol乙和另一化合物,该化合物蒸气的密度是相同状况下氢气的174倍,其化学式是 。
23.(8分)下表是稀硫酸与某金属反应的实验数据:
|
实验
序号 |
金属
质量/g |
金属
状态 |
C(H2SO4)
/mol·L-1 |
V(H2SO4)
/mL |
溶液温度/℃ |
金属消失
的时间/s | |
反应前 |
反应后 | |
1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 | |
2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 | |
3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 | |
4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 | |
5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 | |
6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 | |
7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 | |
8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 | |
9 |
0.10 |
丝 |
1.1 |
50 |
20 |
44 |
40 | | ![]()
![]()
![]()
![]() 溶液与
溶液与 ![]() 溶液反应
溶液反应 ![]()
![]()



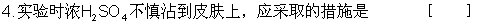




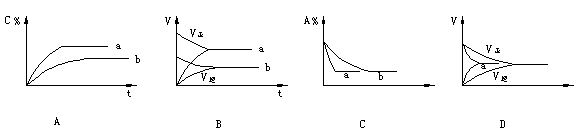
 D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) 第Ⅱ卷(非选择题 共80分)
第Ⅱ卷(非选择题 共80分)

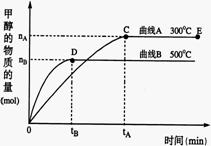 26.(10分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
26.(10分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):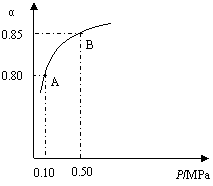 某温度下,SO2的平衡转化率(α)与体系总压强
某温度下,SO2的平衡转化率(α)与体系总压强
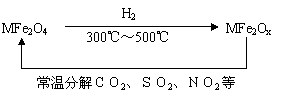 (3)新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
 (2) ①
(2) ①