推荐文章
- 化学计算专项训练三及答案
- 化学学科高考模拟试卷
- 化学反应速率和化学平衡
- 化学反应速率 化学平衡
- 化学元素及化合物所有化学方程式
- 08届高三化学第一学期期终考试模拟卷3
- 08届高三化学第一学期期中统一考试
- 08届高三化学第9月测试题
- 08届高三化学碱金属单元测试题1
- 08届高三化学电解质溶液专题练习
- 08届高三化学氧碳氮知识测试
- 08届高三化学暑期统一考试试题
08届高三化学基础调研测试2
08届高三化学基础调研测试
第Ⅰ卷
一、单项选择题(本题包括5小题,每题3分,共15分。每小题只有一个选项符合题意)
1.2007年据世界卫生组织统计,最常用避孕环是含金属铜的。金属铜的避孕机理之一是:铜与人体分泌物中的盐酸以及子宫内的空气反应:Cu HCl O2=CuCl HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是
A.氧化产物是HO2 B.HO2在碱中能稳定存在
C.氧化剂是O2 D.1 mol Cu参加反应有2 mol电子发生转移
2.下列实验中金属或氧化物可以完全溶解的是
A、1 mol铜片与含2 mol H2SO4的浓硫酸共热
B、1 mol MnO2粉末与含2 mol H2O2的溶液共热
C、常温下1 mol铝片投入足量的浓硫酸中
D、常温下1 mol铜片投人含4 mol HNO3的浓硝酸中
3.下列实验操作正确的是
A.粗盐提纯时,为了加快过滤速率,可用玻璃棒搅拌过滤器中的液体
B.容量瓶检漏:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,反复倒置数次,观察是否漏水
C.不慎将浓苛性钠溶液沾到皮肤上,立即用H2SO4 中和并洗涤
D.测定溶液pH的操作:将pH试纸置于表面皿上,用玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡比较
4.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH+H2O(l)=CO2(g)+3H2(g);△H=+93.0kJ/mol
②CH3OH+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9kJ/mol
下列说法正确的是
A、CH3OH的燃烧热为192.9 kJ/mol B、CH3OH的燃烧热为764.7 kJ/mol
C、CH3OH的燃烧热为392.7 kJ/mol D、不能算出其燃烧热
5.三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有: HF、 NO 和 HNO3 。则下列说法错误的是:
A.反应过程中,被氧化与被还原的元素的物质的量之比为1:2
B.NF3是一种无色、无臭的气体,因此NF3在空气中泄漏时不易被察觉
C.一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染
D.若反应中生成1.0mol NO,转移的电子数目为6.02×1023
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或二个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
6.固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构。该物质适当加热就分解成两种气体。下列关于A的说法正确的是:
A.固体A属于分子晶体 B.A加热分解产生的两种气体是氨气和氢气
C.A与水发生的反应是氧化还原反应 D.A属于铵盐,溶于水后,水解呈酸性
7.工业生产中物质的循环利用有多种模式。例如:
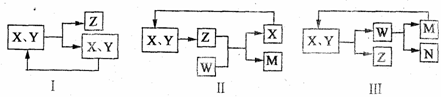
下列表述正确的是
A、图I可用于合成氨中的N2、H2的循环
B、图I可用于氨碱法制纯碱中CO2的循环
C、图Ⅱ可用于电解饱和食盐水中NaCl的循环
D、图Ⅲ可用于氨氧化法制硝酸中NO的循环
8.已知25℃时,AgI饱和溶液中c (Ag )为1.22×10—8mol/L,AgCl的饱和溶液中c (Ag )为1.25×10—5mol/L。若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/LAgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是
A.c (K )>c (NO3—) >c (Cl—) >c (Ag )>c (I—)
B.c (K )>c (NO3—) >c (Ag ) >c (Cl—)>c (I—)
C.c (NO3—)>c (K )>c (Ag ) >c (Cl—)>c (I—)
D.c (K )>c (NO3—) >c (Ag ) = c (Cl—) c (I—)
9.对于平衡:2A 2B ![]() C 2D 3E H2O(A、B、C、D、E为溶液中可自由移动的微粒),下列判定正确的是:
C 2D 3E H2O(A、B、C、D、E为溶液中可自由移动的微粒),下列判定正确的是:
A.加水平衡左移
B.增加A,可提高B的转化率
C.平衡后,按起始投料比,再次投入A和B,则A和B的转化率都将增大
D.升温该平衡一定发生移动。
10.25℃时,在25 mL o.1 mol·L-1的NaOH溶液中,逐滴加入 0.2 mol·Lˉ1的CH3COOH溶液。溶液pH的变化曲线如图所示。下列分析的结论中,正确的是
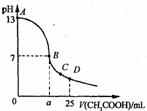 A、B点的横坐标a=12.5
A、B点的横坐标a=12.5
B、C点时c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C、D点时c(CH3COO-)+c(CH3COOH)=2c(Na+)
D、曲线上A、B间任一点,溶液中都有:
c(Na+)>c(CH3COOˉ)>c(OH-)>c(H+)
11.下列反应的离子方程式正确的是
①亚硫酸钠溶液中加入硝酸:SO32- 2H = H2O SO2↑
②澄清石灰水跟稀硝酸反应:Ca(OH)2 2H = Ca2 2H2O
③向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2 2OH- H SO42- NH4 =BaSO4↓ NH3↑ 2H2O
④0.1molFeBr2中滴入含Cl20.1mol氯水:2Fe2++4Br-+3Cl2=2Fe3++2Br2 +6Cl-
|
⑥硫化钠的水解:S2- 2H2O SHAPE \* MERGEFORMAT ![]()
![]() H2S 2OH-
H2S 2OH-
⑦向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:Ca2 HCO3- OH-=CaCO3↓ H2O
⑧苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO 32-
A.③⑤ B.①③ C.③⑤⑥ D.①②④⑥
12.某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A = H HA-,HA- ![]() H A2-,又知0.1mol·L-1NaHA溶液的pH = 2。则下列说法不正确的是:
H A2-,又知0.1mol·L-1NaHA溶液的pH = 2。则下列说法不正确的是:
A.因为A2- H2O ![]() HA- OH-,所以Na2A溶液显碱性
HA- OH-,所以Na2A溶液显碱性
B.0.1mol·L-1 H2A溶液中氢离子的物质的量浓度为0.11 mol·L-1
C.NaHA溶液中各种离子浓度的关系是c(Na ) > c(HA-) > c(H ) > c(A2-) > c(OH- )
D.在NaHA溶液中,HA-电离的趋势大于其水解的趋势
13.在室温下,向一定量的稀氨水中逐滴加入物质的量浓度相同的稀盐酸,直至盐酸过量。则下列叙述正确的是
A.在实验过程中水的电离程度的变化趋势是先减小后增大
B.当滴加盐酸至溶液pH=7时,此时溶液中,c(NH4 )=c(Cl-)
C.当滴加盐酸至溶液pH<7时,此时溶液中溶质一定是HCl和NH4Cl
D.若滴加盐酸后,溶液pH >7,则此时溶液中溶质一定是NH4Cl和NH3·H2O
第Ⅱ卷
三、(本题包括3小题,共11分)
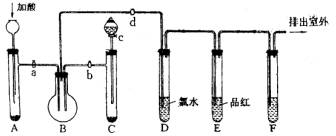
14.(6分)已知: NO3-+4H++3e→NO+2H2O 。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中有一种(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:___________________________________。
(2)反应中硝酸体现了________________ 、________________ 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是________________ mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:_________
________________________________。
15.(2分)到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源。
(1)已知:2Fe 3/2O2 = Fe2O3,△H = —Q1 kJ/mol; 2Al 3/2O2 = Al 2O3,△H = —Q2 kJ/mol ,则Q1 Q2(填“>”,“<”或“=”);
(2)已知:CaCO3(s) == CaO(s) CO2(g);ΔH=178.2kJ·mol-1,该反应自发进行的条件是 。
16.(3分)某无色溶液可能含有下列离子中的几种:H 、Mg2 、Na 、Ag 、Cl-、OH-、HCO3-、NO3-,已知该溶液能和金属铝反应,放出的气体只有氢气。试推断:若溶液和铝反应后有AlO2-生成,则原溶液中一定大量含有的离子是___ __ _,还可能有较大量的离子是_____ _;若溶液和铝反应后有Al3 生成,则原溶液中一定不大量含有的离子是__ ____。
四、(本题包括2小题,共16分)
17.(10分)已知X和Y是由两种中学常见元素组成的化合物,A、B为气体,G为白色沉淀,F是一种两性化合物,在电解开始时溶液中有白色沉淀产生,但随着电解的进行,白色沉淀逐渐溶解,最后变为C的澄清溶液,X、W、E的焰色反应均为黄色。X~G各物质之间的关系如图(部分产物已略去,除气体间的反应外,其余反应均在溶液中进行)。
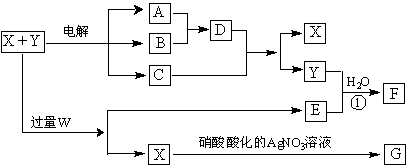
⑴X、Y、W的化学式分别为_____________________________________;
⑵写出反应①和电解开始时的离子方程式:
① ;② ;
⑶若要在电解后期得到C的澄清溶液,X和Y必须满足的条件是:____ _ 。
⑷向C的澄清液中加入1mol/L的硫酸,当加至50mL时才开始出现沉淀。假设电解过程中溶液体积变化忽略不计,原X和Y混合液的体积为100ml,原Y溶液的物质的量浓度为amol/L,则原X溶液的物质的量浓度为 mol/L。
18.(6分)铁合金是金属材料王国的霸主,亚铁盐、铁盐、高铁酸盐等铁的重要化合物也在不同领域中个扮演着重要的角色。这些化合物之间可以相互转化,利用转化过程中发生的特征变化,不仅能够实现物质或能量的转化,还用于化学的定性或定量研究。
![]()
已知FeO42-只能在强碱性介质中稳定存在,在酸性介质或水中不稳定:
4FeO42- 20 H ==4Fe3 3 O2↑ 10 H2O;
4FeO42- 10 H2O== 4Fe(OH)3 3 O2↑ 8 OH-
请利用下列用品:FeCl2溶液(浅绿色)、FeCl3溶液(黄色)、Na2FeO4溶液(紫红色)、铁粉、KSCN溶液、NaOH溶液、NaClO溶液、盐酸、金属锌片、惰性电极(或放电物质做电极)材料、蒸馏水及必要的实验仪器完成下列任务:
(1)设计一个实现上述转化④的实验方案(要求产物纯净),写出简要的实验步骤:
(2)在浓碱中,用NaClO可以实现转化②,这一反应的离子方程式为:
。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M = Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
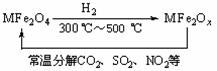
请写出MFe2Ox分解SO2的化学方程式________________________________(不必配平)。五、(本题包括3小题,共23分)
19.(8分)有下图所示的装置:
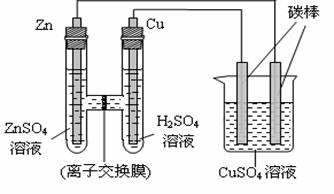
该装置中离子交换膜只答应 离子通过。反应一段时间后,向烧杯中加入0.1mol Cu(OH)2后恰好恢复到反应前的CuSO4溶液的浓度和pH。则反应过程中消耗锌的质量为 g ,烧杯左侧碳棒上析出物质的量为 mol。在此过程中,铜棒及烧杯右侧碳棒上发生的电极反应依次为:
铜棒: ;碳棒:
20.(7分)下左表是元素周期表的一部分。表中所列的字母分别代表某一元素。
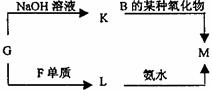
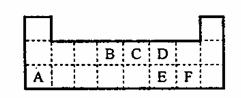
(1)1molA与D的氢化物完全反应产生的气体在标准状况下的体积为 。(2)写出B的最高价氧化物的电子式 。
(3)表中的另一种金属元素(未标出)的单质G,可以发生如上右图所示转化,其中化合物M是一种白色胶状沉淀,则M为(填经学式) ;K的溶液与B的某种氧化物反应的化学方程式为 。
(4)表中的另一种非金属元素(未标出)H与C元素组成一种新型无机非金属材料,该新型无机非金属材料抗腐蚀能力强,除氢氟酸外,它不与其它无机酸反应,试推测该无机非金属材料被氢氟酸腐蚀的化学方程式 。
21.(8分)10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度(℃)
10
20
30
加热煮沸后冷却到50℃
pH
8.3
8.4
8.5
8.8



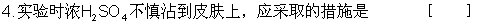




 (1)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填右图中的序号)。
(1)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填右图中的序号)。