电离度
1.有A、B、C三种一元弱酸的浓度均为0.1mol/L。在室温下A溶液中的[OH-]=0.76×10-11mol/L;B溶液中B的电离度为1.15%;C溶液的pH=3。则这三种溶液的酸性从强到弱的顺序为
[Key] A > B > C
2.用蒸馏水逐滴稀释醋酸时,下列数据的数值能保持增大趋势的是
A.[H+] B.H+个数 C.KW D.[CH3COO-]/[H+]
[Key] B
3.在相同状况下的两杯甲酸溶液, 第一杯甲酸溶液的浓度为C1,其电离度为a1;第二杯甲酸溶液的浓度为C2,其电离度为a2.若第二杯甲酸溶液中甲酸根离子的浓度恰为C1,则必然有
A.第一杯溶液的pH小于第二杯溶液的pH B.C1>C2 C.a1>a2 D.a1<a2
[Key] C
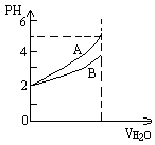 4.pH=2的两种溶液A和B,分别加水稀释1000倍,其pH与所加水的体积变化趋势示意图如右图.下列结论正确的是
4.pH=2的两种溶液A和B,分别加水稀释1000倍,其pH与所加水的体积变化趋势示意图如右图.下列结论正确的是
A.电离度aA < aB B.A、B都是弱酸
C.物质的量浓度B > A D.导电能力A > B
[Key] C
5.在25℃时,醋酸的质量分数为0.6%的溶液,电离度为1%,溶液密度为1g/mL,则溶液
A.[H+]=0.1mol/L B.[OH-]=10-11mol/L
C.pH=2 D. [OH-]=10-10mol/L
[Key] B
6.氨溶于水形成的溶液中存在下列平衡:NH3+H2O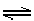 NH3·H2O
NH3·H2O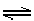 NH4++OH-
NH4++OH-
要使0.5mol/L的氨水中[NH4+]增大,氨水的电离度也增大,可采取的措施是
①加少量KCl晶体 ②通入少量CO2 ③加热 ④加少量NH4Cl晶体 ⑤加少量水 ⑥加少量NaOH晶体 ⑦通入少量HCl气
A.只有③⑤ B.②③⑤⑥ C.①④⑤ D.只有②⑦
[Key] D
7.要使0.1mol/L CH3COOH溶液中CH3COOH的电离度和pH都减小,同时又使CH3COO-浓度增大;可加入的试剂是
A.CH3COONa晶体 B.氨水 C.1mol/L H2SO4溶液 D.1mol/L CH3COOH溶液
[Key] D
8.浓度均为0.1mol/L的四种一元酸:Ha、Hb、Hc、Hd,已知Ha的[H+]为0.01mol/L,Hb的电离度为0.1%,Hc的pH为3,Hd的[OH-]=1×10-13mol/L.它们的四种钾盐在物质的量浓度相同的溶液中,其pH大小顺序正确的是
A.Ha>Hb>Hc>Hd B.Hd>Hc>Hb>Ha C.Hc>Hb>Hd>Ha D.Hb>Hc>Ha>Hd
[Key] D
9.在1升浓度为c摩/升的弱酸HA溶液中,HA、H+和A-的物质的量之和为nc摩,则HA的电离度是
(A)n×100% (B)(n/2) ×100% (C)(n-1) ×100% (D)n%
[Key]C
10.甲酸的下列性质中,可以证明它是弱电解质的是
A.1摩/升甲酸溶液的pH值约为2 B.甲酸能与水以任何比例互溶
C.10毫升1摩/升甲酸恰好与10毫升1摩/升NaOH溶液完全反应
D.在相同条件下,甲酸溶液的导电性比强酸溶液的弱
[Key]AD
11.C1、C2、α1、α2,pH1,pH2分别表示2种一元弱酸的摩尔浓度、电离度和溶液的pH值如果已知pH1<pH2,且α1>α2,则C1和C2的关系
A.C1>C2 B.C1=C2 C.C1<C2 D.无法确定
[Key]D
12.根据下表数据,比较相同温度下,3种酸的相对强弱,正确的是()。
(A)HX>HY>HZ; (B)HZ>HX>HY;
(C)HY>HZ>HX; (D)HZ>HY>HX。
|
酸 |
HX |
HY |
HZ |
|
浓度(mol/L) |
0.1 |
0.5 |
0.9 |
1 |
1 |
|
a(%) |
0.3 |
0.15 |
0.1 |
0.3 |
10 |
13.同温度下的两种稀氨水A和B,A溶液的浓度是Cmol/L、电离度为a1;B溶液中[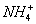 ]为Cmol/L、电离度为a2。下列判断中错误的是( )。
]为Cmol/L、电离度为a2。下列判断中错误的是( )。
(A)A溶液中的[OH-]是B溶液中[OH-]的a1倍; (B)a1>a2;
(C)B溶液的物质的量浓度可表示为c/a2mol/L;
(D)A溶液的pH值大于B溶液的pH值。