第I卷(选择题 共46分)
相对原子质量:H—1 C—12 N—14 O—16 Na—23 K—39
Mg—24 Cl—35.5 S—32 Fe—56 Cu—64 Zn—65
一、选择题(本题包括8小题,每小题2分,共16分。每小题只有一个选项符合题意。)
1.有关能源的下列说法不正确的是( )
A.煤、石油、天然气均为化石能源
B.化石能源是非再生能源
C.氢能是可再生能源
D.氢能、核能均是无污染的高效能源
2.下列过程一定不属于化学过程的是( )
A、变色眼镜在阳光下变色
B、汽水瓶打开后产生很多气泡
C、蚊子蚂蚁或蜜蜂叮螫后涂点氨水或肥皂水减轻痛痒
D、漂白粉消毒漂白自来水
3.我国著名化学家,北京大学张青莲教授近年测定的镧系元素铕和铈的原子量,已被国际化学组织(ICO)采用。已知铈元素的一种原子的质量数为140,中子数为82,则此原子的电子数为( )
A、82 B、140 C、58 D、222
4.下列操作中用错试剂的是( )
A、用食醋清洗水壶中的水垢
B、用酒精萃取碘水中的碘
C、用浓硝酸洗去残留在试管壁上的银镜
D、用碱石灰吸收氨气中的水蒸气
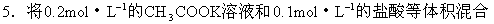
后,溶液中离子浓度关系正确的是( )
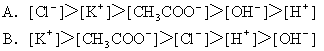
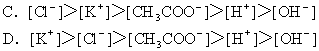
6. 在pH=2的溶液中,下列各组离子可能大量共存的是( )
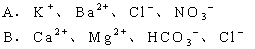
7.“绿色化学”是指从技术、经济上设计可行的化学反应,尽可能减少对环境的负作用。下列化学反应,不符合绿色化学概念的是( )
A、消除硫酸厂尾气排放 SO2+NH3+H2O==(NH4)2SO3
B、消除制硝酸工业尾气的氮氧化物污染 NO2+NO+NaOH==2NaNO2+H2O
C、制CuSO4 Cu+2H2SO4(浓)==CuSO4+SO2↑+2H2O
D、制CuSO4 2Cu+O2==2CuO CuO+H2SO4(稀)==CuSO4+H2O
8.用NA表示阿佛加德罗常数、以下说法正确的是( )


二.选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
9.下列离子方程式正确的是( )


10.已知下列物质在一定条件下氧化KI时,自身发生如下变化:Fe3+→Fe2+;MnO4-→Mn2+;Cl2→Cl-;HNO3→NO。如果分别用等物质的量这些物质氧化足量的KI,得到I2最少的是:
A.Fe3+ B.MnO4- C.Cl2 D.HNO3
11.设NA为阿佛加德罗常数,下列说法不正确的是( )
A、标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA
B、18g水中含有的电子数为10NA
C、46g 二氧化氮和46g四氧化二氮含有的原子数均为3NA
D、在1L1mol/L的硝酸镁溶液中含有的硝酸根离子数为2NA
12.在一定温度下,容器内某一反应中气体M、N的物质的量随反应时间变化的曲线如右图,下列表述中正确的是( )
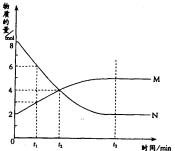 A、反应的化学方程式为:2M
A、反应的化学方程式为:2M N
N
B、t2时,正逆反应速率相等,达到平衡
C、t3时,正反应速率大于逆反应速率
D、t1时,N的浓度是M浓度的2倍
13.打算将一些根系发育完善的新鲜水稻苗进行无土栽培。现需配制一定量含50 mol NH4Cl、16 mol KCl和24molK2SO4的营养液。若用NH4Cl、KCl和(NH4)2SO4三种固体为原料来配制,三者的物质的量依次是(单位为mol)( )
A、2 64 24 B、64 2 24 C、32 50 12 D、16 50 24
14.下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
A、 S2-、NO3-、Fe2+、Na+
B、Ag+、NO3-、Cl-、K+
B、 K+、Ba2+、OH-、SO42-
D、Fe3+、NH4+、Br-、I-
15.下列反应的离子方程式错误的是( )
A、 碳酸氢钙溶液中加人过量氢氧化钠
Ca2++HCO3-+OH-→CaCO3↓+H2O
B、等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合
Ba2++2OH-+NH4++HCO3-→BaCO3↓+NH3·H2O+H2O
C、 氢氧化铝与足量盐酸反应
Al(OH)3+3H+→Al3++3H2O
D、过量CO2通入氢氧化钠溶液中
CO2+OH-→HCO3-
16.把水滴入盛有Na2O2固体的试管中检验生成的气体可以选用( )
A.点燃的酒精灯 B.红热的铁丝
C.带火星的木条 D.干燥的棉花
17.将2.1g由CO和H2组成的混合气体,在足量的氧气中充分燃烧后立即通入足量的Na2O2固体中,固体的质量增重( )
A.2.1g B.3.6g C.4.2g D.7.2g
18.已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的是( )
A.X的能量一定高于M
B.Y的能量一定高于N
C.X和Y的总能量一定高于M和N的总能量
D.因该反应为放热反应,故不必加热就可发生
第一卷答题卡
|
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
第II卷(非选择题 共54分)
三.(本题包括2小题,共18分)
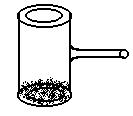 19.(6分)实验室里常见到如图所示的仪器,该议器为两头密封的玻璃管,中间带有一根玻璃短柄。当玻璃管内装有碘时,用此仪器进行碘的升华实验,具有装置简单,操作方便,现象明显,可反复使用等优点。
19.(6分)实验室里常见到如图所示的仪器,该议器为两头密封的玻璃管,中间带有一根玻璃短柄。当玻璃管内装有碘时,用此仪器进行碘的升华实验,具有装置简单,操作方便,现象明显,可反复使用等优点。
1)用此仪器不能反复进行的实验是( )
A、NH4Cl受热分解的实验
B、KMnO4受热分解的实验
C、白磷和红磷在一定条件下相互转变的实验
D、无水CuSO4与胆矾的互变实验
2)当玻璃管内装有NO2和N2O4的混合气体时,亦可反复进行反应条件对化学平衡影响的实验,该实验的操作过程和实验现象是____________________________________________
_______________________________________________________________。
20、实验室配制500mL0.1mol/LNa2CO3溶液回答下列问题
(1)应用托盘天平称取十水碳酸钠晶体_______g(2分)
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,天平平衡时,则实际称量的碳酸钠晶体是______g(1g以下用游码)(2分)
(3)用托盘天平和小烧杯称出碳酸钠晶体的质量,其正确操作顺序的标号为_______________(同一步骤可用多次)(2分)
A.调整零点
B.将游码移至刻度尺的零刻度处
C.将碳酸钠晶体放入小烧杯中称量
D.称量空的小烧杯
E.将砝码放回砝码盒内
F.记录称量结果.
(4)配制Na2CO3溶液时需用的主要仪器有____________________(2分)
(5)若实验遇下列情况,溶液的浓度是偏高,偏低还是不变?(4分)
A.加水时越过刻度线_________
B.忘记将洗涤液加入容量瓶__________
C.容量瓶内壁附有水珠而未干燥处理____________
D.定容后摇匀液面低于刻度线______________
四.(本题包括3小题,共22分)
21.某溶液中可能含有Cl-,CO32-,SO42-,HCO3-,NO3-等阴离子。当溶液中阳离子的存在是(1)溶液中有大量H+存在时,则溶液中不可能存在 离子 :(2)溶液中有大量Ba2+存在时,则溶液中不可能存在 离子;(3)在溶液中有大量 和 离子时,上述所有离子都能大量存在。(6分)
22.(8分)已知X为FeO和CuO的混合物,取两份等质量的X样品进行下列实验: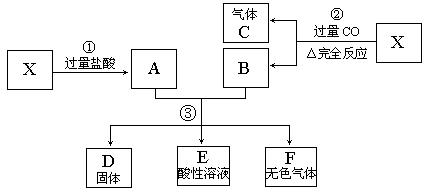
(1)写出 = 1 * GB3 ①和③步所有反应的离子方程式。(4分)
= 1 * GB3 ①__________________________________________________________________
③__________________________________________________________________
(2)设从③步所得固体D的质量为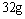 ,溶液E中只含有一种金属离子,气体F在标准状况下体积为
,溶液E中只含有一种金属离子,气体F在标准状况下体积为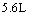 ,则取用的每份X的质量为______g,X中FeO和CuO的质量比为_____。
,则取用的每份X的质量为______g,X中FeO和CuO的质量比为_____。
23.1999年诺贝尔化学奖授予具有埃及和美国双重国籍的科学家艾哈迈德·泽维尔,以表彰他使“运用激光技术观测化学反应时原子的运动成为可能”。(8分)
(1).泽维尔用飞秒(时间单位:1飞秒=10-15秒)激光技术研究了氰化碘(ICN)的分解反应 ICN→I+CN,发现该变化可在200飞秒内完成。已知(CN)2和卤素的性质相似。以下有关ICN的叙述中正确的是
A ICN不能和NaOH溶液反应
B ICN是一种共价化合物
C 将ICN加入到AgNO3溶液中可生成黑色沉淀
D ICN的晶体是分子晶体
(2).泽维尔研究发现,当激光脉冲照射NaI时,Na+和I-两核间距1~1.5nm,呈离子键;当两核靠近约距0.28nm,呈共价健。以下叙述中正确的是
A 共价键和离子键之间没有明显的界限
B NaI晶体中既有离子键,又有共价键
C 离子晶体中可能含共价键
D NaI晶体是离子晶体和分子晶体的混合物
(3).泽维尔用四氟二碘化碳做了下面的实验:
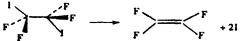
(“…”表示伸向纸内,“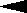 ”表示伸向纸外)
”表示伸向纸外)
发现两个完全相同的C-I键是一先一后断裂的。以下有关上述反应类型的判断中正确的是
A 取代反应 B 加成反应 C 消去反应 D 加聚反应
(4).泽维尔证实了光可诱发下列过程:
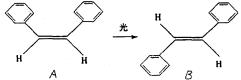
这一事实可用于解释人眼的夜视功能和叶绿素在光合作用中极高的光能利用率。以下叙述中正确的是
A 上述变化是化学变化
B A、B是同一种物质
C A、B的分子式是C14H14
D A、B都能发生加聚反应
五、计算题(14分)
24、将Na2O2与NaHCO3固体混和物置于密闭容器中加热充分反应,放出气体后冷却,可能发生的反应为:
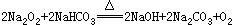
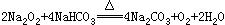
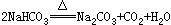
(1) 若原有固体混和物的质量为W克,反应后冷却再称量其质量减少△W克,设NaHCO3和Na2O2的物质的量分别为amol和bmol.试确定在下述各条件下△W的取值范围(用含W的代数式表示)(6分)
当a:b≤1 时 ΔW的取值范围是____________________________
当1<a:b≤2时 ΔW的取值范围是____________________________
当a:b>2时 ΔW的取值范围是____________________________
(2) 若W=14.52克, ΔW=1.28克,试计算原混和物固体中各成分的物质的量?
(3) 若把(2)中原固体放入水中最后配成100毫升溶液,试计算溶液的物质的量浓度?
永丰中学第一次统考化学答案 2001.10.6
|
题 |
01 |
02 |
03 |
04 |
05 |
06 |
07 |
08 |
09 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
答 |
D |
B |
C |
B |
B |
A |
C |
C |
B |
A |
A |
D |
A |
D |
A |
C |
A |
C |
19.(本题共6分)
(1)B (2分) (2)升温,颜色加深。(2分)降温,颜色变浅。(2分)
20.(本题共12分)
(1)14.3克
(2)13.7克
(3)BADFCFEB
(4)烧杯、天平、玻璃棒、容量瓶、滴管、药匙。
(5)低、低、无、无。
21.(本题共6分)
(1)CO32-,HCO3-(2)SO42-,CO32-(3)K+,Na+
22.(本题共8分)
(1) FeO+2H+=Fe2++H2O, CuO+2H+=Cu2++H2O;
Fe+Cu2+=Fe2++Cu,Fe+2H+=Fe2++H2
(2)56g 9:5
23.(本题共8分)
(1)BD
(2) AC
(3) C
(4) AD
24.(本题共14分)
(1)ΔW≤8W/81, (8W/81)<ΔW≤17W/123, (17W/123)< ΔW<31W/84
(2)Na2O2 0.10mol, NaHCO3 0.08mol
(3)CNaOH=1.2mol/L CNa2CO3=0.8mol/L