|
高三化学上学期第四次月考试题
可能用到的原子量:H:1 C:12 N:14 O:16 Na:23 Cu:64 Mn:55
Fe:56 I:127 Ba:137
第Ⅰ卷 选择题(共70分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
1、金属材料在日常生活以及生产中有着广泛的运用。下列关于金属的一些说法不正确的是
A.合金的性质与其成分金属的性质不完全相同
B.工业上金属Mg、Al都是用电解熔融的氯化物制得的
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.越活泼的金属越难冶炼
2、下列说法正确的是
A.原子晶体中只存在非极性共价键 B.稀有气体形成的晶体属于分子晶体
C.干冰升华时,分子内共价键会发生断裂
D.金属元素和非金属元素形成的化合物一定是离子化合物
3、绿色化学是从源头上防止污染产生或将化学过程对环境的负面影响降低到最低限度的化学。不仅化工生产应遵循绿色化学的原则,化学实验也应遵循绿色化学原则,实现原料和过程的绿色化。下列实验或实验过程遵循绿色化学原则的是
A.用多量的氯气进行性质实验 B.用双氧水代替高锰酸钾制氧气
C.用溴水代替碘水进行萃取实验 D.用铜粉代替铜丝进行Cu和浓HNO3的反应
4、下列有关实验的说法正确的是
A.除去铁粉中混有的少量铝粉.可加人过量的氢氧化钠溶液,完全反应后过滤
B.为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量
C.制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中
D.某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32-
5、氯气和二氧化硫皆可作漂白剂。若同时使用于漂白一种物件时,其漂白效果是
A.增强 B.减弱 C.不变 D.不能确定
6、四种化合物①NaHCO3,②Al(OH)3,③(NH4)2S,④Al中,跟盐酸和氢氧化钠溶液都能反应的是
A.只有②④ B.只有①② C.只有①②③ D.①②③④
7、下列各组离子在指定溶液中能大量共存的是
①无色溶液中:K 、Cu2 、Na 、MnO4-、SO42-
②使pH=11的溶液中:CO32-、Na 、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、NO3-、NH4
④在由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na 、Ba2 、Cl-、I-
⑤能使pH试纸变为蓝色的溶液:Na 、C1-、S2-、SO32-
⑥酸性溶液中:Fe2 、Al3 、NO3-、I-、Cl-
A.①②⑤ B.①③⑥ C.②④⑤ D.①②④
8、有 ① Na2CO3溶液 ② CH3COONa溶液 ③ NaOH溶液各25mL,物质的量浓度均
为0.1mol·L-1,下列说法正确的是
A.3种溶液pH的大小顺序是 ③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25mL0.1mol·L-1盐酸后,pH最大的是①
D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
9、设NA表示阿伏加德罗常数,下列说法中不正确的是
A.一定量的Fe与含1mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA
B.1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
C.0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA
D.125gCuSO4·5H2O晶体中含有0.5NA个Cu2
10、在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M。关于该反应的说法中正确的组合是
① 氧化剂是H3AsO3;② 还原性:Cl->As;③ 每生成7.5gAs,还原剂失去的电子为0.3 mol;④ M为OH-;⑤ SnCl62-是氧化产物。
A.①③⑤ B.①②④⑤ C.①②③④ D.只有①③
二、选择题(本题包括10小题,每小题4分,共40分。每小题有1~2个正确答案符合题意。)
11、关于VIA族和VIIA族元素的下列说法中正确的是
A.在同一周期,VIA族元素氢化物的稳定性比VIIA族的强
B.浓度都是0.01mol·L-1时,硫酸溶液的PH值比氯酸溶液的小
C.VIIA族单质的氧化性均比VIA族单质的氧化性强
D.加热时,硫酸钠比氯酸钠易分解
12、在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正
确的是
A.加入有色布条,一会儿有色布条褪色,说明溶液中有C12存在
B.溶液呈黄绿色,且有刺激性气味,说明有C12分子存在
C.先加入硝酸酸化,再加入AgNO3溶液产生白色沉淀,说明和C1—存在
D.加入NaOH溶液,氯水黄绿色消失,说明有HC1O分子存在
13、茉莉醛具有浓郁的茉莉花香,其结构简式如下所示: SHAPE \* MERGEFORMAT
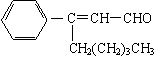
关于茉莉醛的下列叙述不正确的是
A.茉莉醛与苯甲醛互为同系物
B.在加热和催化剂作用下,能被氢气还原生成一种芳香醇
C.一定条件下,能被银氨溶液、新制氢氧化铜等多种氧化剂氧化
D.不能发生加成反应
14、下列离子方程式书写正确的是
A.过量的SO2通入NaOH溶液中:SO2 2OH-=SO32- H2O
B.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3+ 2I-=2Fe2+ I2
C.NaNO2溶液中加入酸性KMnO4溶液:2MnO4- 5NO2- 6H+=2Mn2+ 5NO3- 3H2O
D.NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3- Ba2+ 2OH-=BaCO3↓ 2H2O CO32
15、用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是
|
选项 |
操作及现象 |
溶液 |
|
A |
通入CO2,溶液变浑浊。再升高至65℃以上,
溶液变澄清。 |
C6H5ONa溶液 |
|
B |
通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。 |
Na2SiO3溶液 |
|
C |
通入CO2,溶液变浑浊。再加入品红溶液,红色褪去。 |
Ca(ClO)2溶液 |
|
D |
通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。再加入足量NaOH溶液,又变浑浊。 |
Ca(OH)2溶液 |
16、盛有氯化钡溶液的甲乙两试管分别通入SO2至饱和。若向甲试管中加入足量稀硝酸,乙试管中加入足量氢氧化钠溶液,则下列叙述正确的是 A.甲乙两试管都有白色沉淀生成 B.甲乙两试管都没有白色沉淀生成 C.甲试管没有白色沉淀生成而乙试管有 D.甲试管有白色沉淀生成而乙试管没有
17、下列溶液中各微粒的浓度关系不正确的是
A.0.1 mol·L-1 HCOOH溶液中:c(HCOO-) c(OH-)=c(H+)
B.1 L 0.l mol·L-1CuSO4·(NH4)2SO4·6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-)
C.0.1 mol·L-1NaHCO3溶液中: c(Na+) c(H+) c(H2CO3)=c(HCO3-) c(CO32-) c(OH-)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>(OH-)
18、一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g) 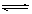 Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是 Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
A.以X浓度变化表示的反应速率为0.001mol/(L·S)
B.将容器体积变为20L,Z的平衡浓度变为原来的0.5倍
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的△H< 0
19、某无色气体可能由O2、CO、CO2、HCl、NH3、NO、Br2中的一种或几种组成,通过图中洗气瓶后气体体积减少(该装置前后都不与大气直接相连),通过干燥管(内盛放Na2O2)后气体呈红棕色,则下列推断正确的是
 A.原气体中一定有NO和O2 A.原气体中一定有NO和O2
B.原气体中一定有NH3、NO、CO2 、CO
C.原气体中一定没有CO
D.原气体中一定没有HCl、Br2 O2
20、a mol FeS与b mol FeO投入到VL、c mol·L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
A.(a b)×63g B.(a b)×189g C.(a b)mol D. 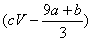 mol mol
第Ⅱ卷 非选择题(共80分)
21、(6分)(1)下面所列的是中学化学实验室中几种常见的仪器:容量瓶、酸式滴定管、碱式滴定管、温度计、量筒、托盘天平、 普通漏斗、玻璃棒、烧杯。①若要进行中和滴定实验,还缺少的玻璃仪器是 ;②若要用碳酸钠固体配制一定物质的量浓度的碳酸钠溶液,还缺少的玻璃仪器是 ;
(2)某学生往一支试管中按一定的顺序分别加入下列几种溶液(一种溶液只加一次):
A.KI溶液 B.淀粉溶液 C.NaOH溶液 D.稀H2SO4 E.氯水。
发现溶液颜色按如下顺序变化:无色→棕黄色→蓝色→无色→蓝色。 依据溶液颜色的变化,判定加入以上药品的顺序是(填写序号) 。
22、(10分)某化学爱好小组在做实验时,将AgNO3溶液和KI溶液混合,发现有黄色沉淀生成,振荡后迅
速消失。大家经查阅资料后,发现可能的原因是发生了下列反应:AgI I-  [AgI2]-。 [AgI2]-。
(1)甲同学设计了两个简单的实验方案来进行验证,请你协助他完成实验。
实验1:向浓KI溶液中滴加AgNO3溶液,现象为 。
实验2:向AgNO3溶液中滴加稀KI溶液,有黄色沉淀生成;再在所得的黄色沉淀中滴加浓KI溶液,现象为 。
(2)乙同学在实验所得的溶液中滴加硝酸溶液,结果又出现了沉淀。请解释出现沉淀的原
因 。
(3)丙同学在实验所得的溶液中滴加氯水也可以看到沉淀,但由于溶液为黄色,分不清沉淀的颜色。
大家通过查阅数据,分析认为产生的沉淀不可能是AgCl,所查阅的数据是 ;请设计简单
的实验说明不会产生AgCl沉淀: 。
23、(16分)硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3 的浓度,防止生成氢氧化铁沉淀,原料中的Fe3 必须先还原为Fe2 。实验步骤如下:

(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 。
(a) 容量瓶 (b) 烧杯 (c) 烧瓶
(2)步骤 = 2 \* ROMAN II取样分析溶液中的Fe2 、Fe3 的含量,目的是 。
(a) 控制溶液中Fe2 与Fe3 含量比 (b) 确定下一步还原所需铁的量
(c) 确定氧化Fe2 所需NaClO3的量 (d) 确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:6FeSO4 NaClO3 3H2SO4 → 3Fe2(SO4)3 NaCl 3H2O
若改用HNO3氧化,则反应方程式如下:6FeSO4 2HNO3 3H2SO4 → 3Fe2(SO4)3 NO↑ 4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的得弊,利是 ,弊是 。
聚合硫酸铁溶液中SO42¯与Fe3 物质的量之比不是3:2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42¯与Fe3 物质的量之比。
(4)测定时所需的试剂是
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
(5)需要测定 和 的质量(填写化合物的化学式)。
(6)选出测定过程中所需的基本操作 (按操作先后顺序列出)。
(a) 溶解、分液 (b) 过滤、洗涤 (c) 蒸发、结晶 (d) 冷却、称量 (e)烘干或灼烧
24、(8分)某些化学反应可用下式表示
A B ─→ C D H2O请回答下列问题:
(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出该反应的离子方程式: 。
(2)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B的组合是 。
(3)若A为Na2O2,B为硫酸,则C和D的化学式是 。
(4)若A为单质,B为第二周期某种元素的最高价氧化物的水化物,请写出符合上式的化学方程式: 。
25、(10分)下图是中学化学中常见的物质间化学反应关系的图示,其中A的焰色反应呈黄色,E、F为有刺激性气味的气体,G为强酸性溶液,H为既难溶于水、也难溶于稀酸的白色固体。
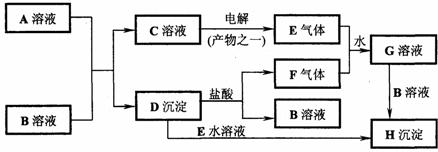
试回答:
(1)写出化学式:A_______________;B_______________。
(2)写出下列反应的离子方程式:
①C→E:_________________________ _____;
②D→H:___________________________ ___;
③E+F+H2O→G:______________ ________________。
26、(18分) 工业生产硝酸铵的流程图如下:
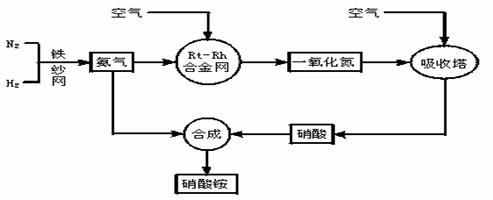
请回答下列问题:
(1)写出硝酸铵在工农业生产中的重要作用_______________________(任写一条)。
(2)已知N2(g) 3H2(g)  2NH3(g) ΔH=-92.4kJ·mol-1。请回答: 2NH3(g) ΔH=-92.4kJ·mol-1。请回答:
①在500℃、200atm和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量______(填“<”“>”“=”)92.4kJ,理由是 。
②为有效提高氢气的转化率,实际生产中宜采取的措施有 。
A.降低温度 B.最适合催化剂活性的适当高温 C.增大压强
D.降低压强 E.循环利用和不断补充氮气 F.及时移出氨
③该反应的化学平衡常数表达式K=________________,当温度升高时,K值______(增大、减小、无影响)。其原因是_____________________________________。
(3)写出氨被加热的铂铑合金网催化氧化的化学方程式:_______________________________________________________________________
(4) 一定温度下在体积固定的密闭容器中,将3mol H2和1mol N2混合,当该反应达到平衡时,测得平衡混合气的压强是反应前的0.85倍,此时N2的转化率为__________。
27、(12分)某芳香烃A有如下转化关系:
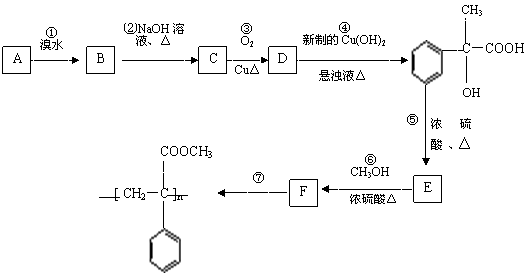
⑴.反应②和⑤的类型:②属于 反应;⑤属于 反应;
⑵.A、F结构简式:A ;F ;
⑶.反应③、⑥的化学方程式:
③ ;
⑥ ;
⑷.D还可以和新制的银氨溶液反应,化学反应方程式为:
。

 08届高三第四次月考化学考试答卷 08届高三第四次月考化学考试答卷
21、(6分)
(1)① ;② ;
(2) 。
22、(10分)
(1) 。
。
(2)
。
(3) ;
。
23、(16分)
(1) 。(2) 。
(3) , 。
(4) (5) 和 。
(6) 。
24、(8分)
(1) 。
(2) 。
(3) 。
(4) 。
25、(10分)
(1) A_______________;B_______________。
(2)①C→E:_________________________ _____;
②D→H:___________________________ ___;
③E+F+H2O→G:______________ ________________。
26、(18分)
(1) ___________ ___________。
(2)①___ ___,
。
② 。
③K=________________, _____ _。_________________________________
_ ___。
(3) _______________________________________________________________________
(4) _______ ___。
27、(12分)
⑴. ; ;⑵A ;F ;
⑶ ③ ;
⑥ ;
⑷.
。
参考答案:
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21、(1)① 锥形瓶 (2分); ② 胶头滴管 (2分)。
(2) A→E→B→C→D (2分,全对才给分)。(每空2分,本题共6分)
22.(每空2分,共10分)
(1)没有沉淀生成 ,黄色沉淀溶解
(2)加入硝酸溶液后,HNO3将I-氧化,使I-浓度减小,平衡AgI I-  [AgI2]-逆向移动 [AgI2]-逆向移动
(3)AgI、AgCl的溶解度 在黄色的AgI沉淀中滴加NaCl溶液,沉淀未转化为白色
23、(16分)(1)b (2分) (2)b、c (2分) (3)利:原料成本较低 弊:产生气体对大气有污染(各2分)(4)a、c (2分) (5)Fe2O3、BaSO4 (各2分)(6)b、e、d(2分)
24.(8分)(1)Cl2 2OH-=Cl- ClO- H2O (2分) (2)C、浓H2SO4 (2分)
(3)Na2SO4、O2 (2分)(4)C 4HNO3(浓)  CO2↑ 4NO2↑ 2H2O (2分) CO2↑ 4NO2↑ 2H2O (2分)
(或:Cu 4HNO3(浓)  Cu(NO3)2 2NO2↑ 2H2O, Cu(NO3)2 2NO2↑ 2H2O,
3Cu 8HNO3(稀)  3Cu(NO3)2 2NO↑ 4H2O,其他合理答案也可) 3Cu(NO3)2 2NO↑ 4H2O,其他合理答案也可)
25、(10分)(1)A:Na2SO3 B:BaCl2 (2)①:2Cl-+2H2O  2OH—+H2↑+Cl2↑ 2OH—+H2↑+Cl2↑
②:BaSO3+C12+H2O=BaSO4↓+2H++2Cl— ③:SO2+C12+2H2O=4H++2C1—+SO42—
26、(1)可做氮肥等;(1分)
(2)①<;(2分)在1atm和298K条件下,1mol氮气和3mol氢气完全反应生成2mol氨气,放出92.4kJ热量,反应为可逆反应,不可能进行完全,又因为反应温度为500℃,所以放出的热量小于92.4kJ;(2分)
②C、E、F(各1分;错1个扣1分,扣完为止)。
③K=c(NH3)2/ c(H2)3 c(N2) ,(2分)减小(2分)氨的合成反应是放热反应,升高温度,有利于逆反应,所以k值减小。(2分)。(3)4NH3 5O2 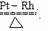 4NO 6H2O(g)。(2分)(4)30% (2分) 4NO 6H2O(g)。(2分)(4)30% (2分)
27、(12分)(1)取代(1分); 消去(1分) 。
(2)A: 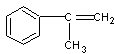 (2分) F: (2分) F: 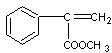 (2分) (2分)
(3)
2 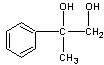 +O2 +O2  2 2 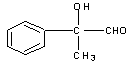 +2H2O(2分) +2H2O(2分)
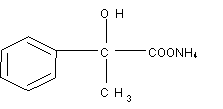 (4) (4)
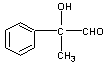 2 Ag(NH3)2OH —— 2Ag 3NH3 H2O(2分) 2 Ag(NH3)2OH —— 2Ag 3NH3 H2O(2分)
|