| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
8、用NA表示阿伏加德罗常数的值,下列说法中正确的是( ) A.用MnO2催化H2O2分解时,每生成11.2L的O2转移NA个电子 B.标准状况下,22.4L SO3中含有的硫原子数目为NA C.标准状况下,2.24L氧元素的单质所含原子数一定为0.2NA D.6.4g S6与S8的混合物中所含硫原子数一定为0.2NA 9、在一定条件下,下列物质不能与二氧化硅反应的是( ) ①焦炭 ②纯碱 ③碳酸钙 ④氢氟酸 ⑤硝酸 ⑥氢氧化钠 ⑦氢氧化钙 A.③⑤⑦ B.⑤⑦ C.③⑤ D.⑤ 10、下列叙述中正确的是( ) ①金属钠不能与NaOH溶液反应;②液溴中溶有少量氯气,可以用加入溴化钠再用汽油萃取的方法提纯;③溴化银具有感光性,碘化银不具感光性;④某溶液与淀粉碘化钾溶液反应出现蓝色,则证实该溶液是氯水或溴水;⑤氟气能与氯化钠水溶液反应生成HF和O2;⑥氯气跟水反应时,水既不是氧化剂也不是还原剂。 A.只有①③⑤ B.只有②④⑥ C.只有②⑤⑥ D.只有①③④ 二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。 若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。) 11、三氟化氮(NF3)是一种无色无味的气体,它是氨和氟(F2)在一定条件下直接反应得到:4NH3 3F2== NF3 3NH4F,下列有关NF3的叙述正确的是 ( ) A.NF3是共价化合物 B.NF3的还原性比NH3强 C.NF3的氧化性比F2强 D.NF3中的N呈+3价 12、下列叙述正确的是( ) ①标准状况下,1molSO2和1molSO3具有相同的体积;②SO2使溴水、高锰酸钾酸性溶液褪色是因为SO2有漂白性;③SO2有漂白性,湿润的氯气也有漂白性,若将SO2和Cl2以等物质的量混合后通入品红溶液中,一定褪色更快;④SO2溶于水,得到的溶液有氧化性,还有还原性;⑤SO2通入Ba(OH)2溶液中,有白色沉淀生成,加入稀硝酸最终沉淀将全部溶解⑥SO2通入BaCl2溶液中无沉淀生成。 A.①② B.③⑤ C.④⑥ D.①③⑥ 13、下列离子方程式书写正确的是( ) A.过量的二氧化硫通入氢氧化钠溶液中:SO2 2OH-=SO42- H2O B.澄清石灰水中通入少量二氧化碳:Ca2 2OH- CO2=CaCO3↓ H2O C.碳酸氢钙溶液和氢氧化钠溶液混合:HCO-3 OH-=CO32- H2O D.碳酸钙和盐酸反应:CO32- 2H =CO2↑ H2O 14、下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,过量B跟氯气反应除生成C外,另一产物是盐酸盐。
下列说法不正确的是( ) A. 当X是强酸时,ABCDEF均含有一种元素,F是硫酸 B. 当X是强碱时,ABCDEF均含同一种元素,F是硝酸 C. B和Cl2的反应是氧化还原反应 D. 当X是强酸时,C常温下是气态单质 15、向1.00 L 0.3 mol/L的NaOH溶液中缓慢通入CO2气体至溶液增重8.8g,所得溶液中( ) A.溶质为Na2CO3 B.溶质为Na2CO3、NaHCO3 C. D.c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H ) 16、把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是( ) A.氧气 B.二氧化氮 C.二氧化氮和氧气 D.二氧化氮和一氧化氮 17、一定条件下,可逆反应C(s) CO2(g) A.①②③④ B.①③ C.①② D.①③④ 18、500 mL KNO3和Cu(N03)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( ) A.原混合溶液中c(K+)为2 mol·L-1 B.上述电解过程中共转移4 mol电子 C.电解得到的Cu的物质的量为0.5 mol D.电解后溶液中c(H+)为2 mol·L-1 19、丁香油酚结构简式如右图所示,下列关于它的性质说法正确的是( )
B.可跟NaHCO3溶液反应放出CO2气体 C.在碱性条件下可发生水解反应 D.可与浓溴水发生取代反应 20、向含0.2mol NaOH和0.1mol Ba(OH)2的溶液中持续稳定地通入6.72L(已换算成标准状况)CO2气体。下列表示溶液中离子的物质的量与通入CO2的体积关系的图象中,符合题意的是(气体的溶解和离子的水解都忽略不计)( )
第二部分 非选择题 (共80分) 三、(本题包括3小题,共30分) 21、(8分)在足量的稀氯化亚铁溶液中加入1~2滴液溴,振荡后溶液变为黄色。 (1)甲同学认为是Br2溶于水变成黄色溶液; 乙认为是Fe2 被氧化成Fe3 使溶液变成黄色。 (2)现提供试剂: A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液 请判定 (填“甲”或“乙”)的推断正确,并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
|
| 选用试剂
| 实验现象
| 第一种方法
|
|
| 第二种方法
|
| |
(3)若选用淀粉碘化钾溶液判定哪位同学的推断正确,是否可行?(填“可行”或“不可行”): ;理由: ;
22、(12分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3+CO2+H2O NH4HCO3 ; NH4HCO3+NaCl NaHCO3↓+NH4Cl ;
![]() 2NaHCO3 Na2CO3+CO2↑+H2O
2NaHCO3 Na2CO3+CO2↑+H2O
回答下列问题:
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号)。
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。

试回答下列有关问题:
![]() (Ⅰ)乙装置中的试剂是 ;
(Ⅰ)乙装置中的试剂是 ;
(Ⅱ)丁装置中稀硫酸的作用是 ;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从 管通入 气体,再从 管中通入 气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 ;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法: 。
23、(10分)KMnO4溶液常用做氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此精确配制KMnO4标准溶液的操作是:
(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸l h;
(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;
(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处:
(4)利用氧化还原滴定方法,在70℃-80℃条件下用基准试剂(纯度高、稳定性好的物质)溶液测定其浓度。
回答下列问题:
(1)为什么要称取稍多于所需的KMnO4固体?___________________________
(2)为什么不用普通滤纸过滤器过滤?__________________________________
(3)如何保证在70℃~80℃条件下进行滴定操作:_______________________
(4)下列物质中,可以用于测定KMnO4溶液浓度的基准试剂是_____________
A.H2C2O4·2H2O B.FeSO4·7H2O C.浓盐酸 D.Na2SO3
(5)若准确称取W g草酸晶体(H2C2O4·2H2O)溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液V mL。
6H++2MnO4-+5H2C2O4·2H2O====2Mn2++10CO2↑+18H2O,问:
①滴定时,高锰酸钾溶液应装在_____ ___________;
②滴定终点标志是_____________ _____;
③KMnO4溶液的物质的量浓度为____ ______________:
④若滴定前平视,滴定后俯视,则测得的浓度值将_____ ___(填“偏高”或偏低)
 四、(本题包括3小题,共32分)
四、(本题包括3小题,共32分)
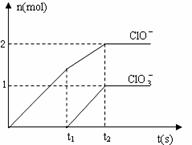
24、(8分)在一定量的石灰乳中通入一定量的氯气,二者
恰好完全反应(发生的反应均为放热反应)。生成物中
含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、
C1O3-两种离子的物质的量(n)与反应时间(t)的曲
线如右图所示。
(1)t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为
__________________________________________。
(2)该石灰乳中含有Ca(OH)2的物质的量是___________________ mol。
(3)据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通入氯气的速度不同,C1O-和C1O3-的比例也不同。
若在原石灰乳中通入氯气的速度加快,则反应后 ![]() 2(填“>”、“<”或“=”);
2(填“>”、“<”或“=”);
若 ![]() ,则n(C1-)= mol(用含a的代数式来表示)。
,则n(C1-)= mol(用含a的代数式来表示)。
25、(10分)2007年诺贝尔化学奖授予德国科学家格哈德·埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献。
 (1)某校化学研究性学习小组的同学在技术人员的指导下,按下列
(1)某校化学研究性学习小组的同学在技术人员的指导下,按下列
流程探究不同催化剂对NH3还原NO反应的催化性能。
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,
将经催化反应后的混合气体通过滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。为比较不同催化剂的催化性能,需要测量并记录的数据是 。
(2)在汽车的排气管上安装“催化转化器”(用铂、钯合金作催化剂),它的作用是使CO、NO反应生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧。
①写出CO与NO反应的化学方程式: ,该反应作氧化剂的物质是_________。
②用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g) 4NO2(g) 4NO(g)+CO2(g) 2H2O(g); ΔH1=-574 kJ·mol-1
CH4(g) 4NO(g) 2N2(g)+CO2(g) 2H2O(g); ΔH2
若1mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则ΔH2= 。
(3)有人认为:该研究可以使氨的合成反应,在铁催化剂表面进行时的效率大大提高,从而使原料的转化率大大提高。请你应用化学基本理论对此观点进行评价:
。
|
高温 |
SiO2 + C+ N2 Si3N4 + CO
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是 ,其还原产物是 ;
(3)该反应的平衡常数表达式为K= ;
(4)若知上述反应为放热反应,则其反应热△H 0(填“>”、“<”或“=”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”);
(5)若使压强增大,则上述平衡向 反应方向移动(填“正”或“逆”);
(6)若已知CO生成速率为v(CO)=18mol/(L.min),
则N2消耗速速率为v(N2)= mol/(L.min)。
五、(本题包括1小题,8分)
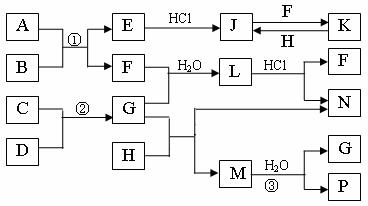 27、下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。
27、下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。
已知:E为红色固体,K为浅绿色溶液;反应②是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G分子构型为三角锥形,化合物M由两种元素组成,分子内共有58个电子。
(1)化合物A中含有的两种元素是 。
(2)F的化学式 ;G的水溶液中,最多的阳离子是 。
(3)写出K与H反应的离子方程式: 。
(4)在实验室中,向饱和H水溶液中加入CaCO3粉末,充分反应后过滤,可制得浓度较大的P的水溶液。使用化学平衡移动原理加以解释
。
六、(选做题,本题共10分)
考生注重:28、29题为选做题,考生可任选一题。
28(A)2007年全世界石油价格居高不下,其主要原因是随着社会生产的发展,人口增多,对能源的需求量逐年增加,全球石油储量下降。寻求和制备代号称“黑金”的新能源已经成为紧迫任务,化学工作者正在研究以天然气和醇类合成优质汽油的方法。
已知:⑴ 凡与醛基直接相连的碳原子上的氢称为α一H原子,在稀碱溶液的催化作用下,一个醛分子上的α一H原子连接到另一个醛分子的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:
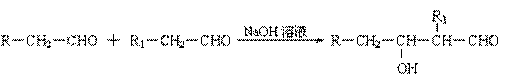 |
![]() ⑵
⑵
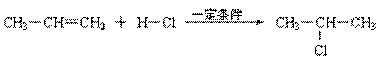 |
⑶合成路线如下:
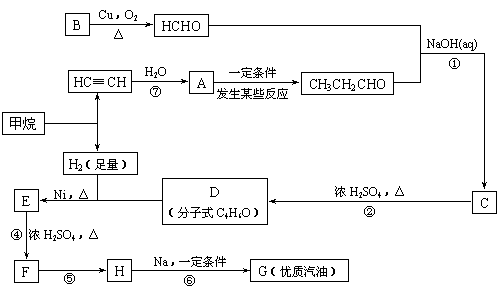
(1)写出D的结构简式
(2)在反应②~⑦中,属于加成反应的是 ,属于消去反应的是 。
(3)写出反应方程式
E → F: ;
(4)H也能与NaOH水溶液反应,其反应方程式为
。
28(B)(10分)下表是元素周期表中第一、第二周期10种元素的某种性质的一组数据(所列数据的单位是相同的)。除带“……”的四种元素除外,其余元素都给出了该种元素的全部该类数据。
(H)
13.6
(He)
24.6
54.4
(Li)
5.4
75.6
122.5
(Be)
9.3
18.2
153.9
217.7
(B)
8.3
25.2
37.9
259.4
340.2
(C)
11.3
24.4
47.9
64.5
392.1
489.9
(N)
14.5
29.6
47.4
72.5
97.9
552.1
……
(O)
13.6
35.1
……
……
……
……
……
……
(F)
17.4
34.9
……
……
……
……
……
……
……
(Ne)
21.6
41.6
……
……
……
……
……
……
……
……
研究这些数据:
(1)每组数据可能是该元素的________________
A.原子得到电子所放出的能量 B.原子半径的大小
C.原子逐个失去电子所吸收的能量 D.原子及形成不同分子的半径的大小
(2)分析同周期自左往右各元素原子的第一个数据
①总体变化趋势是_______(填“增大”或“减小”),②与前后元素相比,由于该元素的数值增大得较多而变为反常的元素是在________族,分析它们的原子核外电子排布后,指出造成上述反常情况的可能原因是_________________
A.它们的原子半径忽然变小些 B.它们的核外电子排布处于饱和状态
C.它们的原子半径忽然变大些 D.它们的核外电子排布处于半布满或全布满状态
根据以上规律,请推测镁和铝的第一个数据的大小Mg(1)_____Al(1)
(3)同一元素原子的一组数据是约以倍比关系增大,请你说出可能的一个原因是_________________________________________________,每个元素的一组数据中个别地方增大的比例非凡大,形成突跃(大幅度增大),请找出这些数据,并根据这些数据出现的规律,你认为氧元素出现该情况的数据应该是氧元素8个数据的第_______个。
上述规律可以证实原子结构中_______________________________的结论。
高三化学模拟考试(二)
化学参考答案
第一部分 选择题 (共70分)
一、单项选择题(本题包括10小题,每小题3分,共30。每小题只有一个选项符合题意)
|
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
答案 |
B |
C |
D |
A |
D |
A |
C |
D |
D |
C |
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。 若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
|
题号 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
答案 |
AD |
C |
B |
D |
BD |
C |
B |
AB |
AD |
C |
第二部分 非选择题 (共80分)
三、(本题包括3小题,共30分)
21、(8分)(2) 乙 (1分)
选用试剂
实验现象
第一种方法
C (1分)
有机层无色 (1分)
第二种方法
D (1分)
溶液变红 (1分)
(3)①不可行(1分),因为Br2和Fe3 都能把I— 氧化成I2 (2分))
22、(12分) (1)c (1分)
(2)①(Ⅰ)饱和碳酸氢钠溶液;(Ⅱ)吸收未反应的NH3(答“防止倒吸”或“吸收CO2”不给分));(Ⅲ)过滤 (每空1分,共3分)
②(Ⅰ)a、NH3, b、CO2; (每空1分,共4分)
(Ⅱ)增大气体与溶液接触面积,提高CO2吸收率; (2分)
(3)用碳酸氢铵与适量饱和食盐水反应。(或往烧碱溶液中通入过量CO2 ;往饱和Na2CO3 溶液中通入过量CO2 等。其他合理方法均可) (2分)
23、(l 0分)(1)有部分KMnO4被还原成MnO(OH)2 (1分)
(2)KMnO4的强氧化性能氧化滤纸(1分)
(3)可在水浴中加热(1分) (4)A (1分)
(5)酸式滴定管(2分),当最后滴下1滴KMnO4溶液后半分钟不褪色时(1分) 10w/63V (2分)偏高 (1分)
四、(本题包括3小题,共32分)
24.(1)10Ca(OH)2+10Cl2=2Ca(C1O)2+Ca(C1O3)2+7CaCl2+10H2O
(2)5 ⑶< 5(a 5)/(a 3)(每空2分,共8分)
25、(每空2分,共10分)
(1)溶液显色所需要的时间
(2)①2CO 2NO ![]() N2 2CO2 NO ②-1160 kJ·mol-1
N2 2CO2 NO ②-1160 kJ·mol-1
(3)该研究只能提高化学反应速率,不能使化学平衡发生移动
26、(14分)
(1)3,6,2,1,6(2分) (2)N2(1分),Si3N4(1分)
![]() (2分)
(2分)
(4)<(2分);减小(2分) (5)逆(2分) (6)6(2分)
27、(12分)
(1)S、Fe(2分)
(2)SO2 (1分) NH4 (1分)
(3)2Fe2 Cl2=2 Fe3 2Cl- (2分)
(4)饱和H水溶液中存在平衡:Cl2+H2O ![]() H +Cl-+HClO,加入的CaCO3粉末与H 反应,平衡正向移动,HClO浓度增大(2分)
H +Cl-+HClO,加入的CaCO3粉末与H 反应,平衡正向移动,HClO浓度增大(2分)
28(A)(每空2分,共10分)
(1)略(2)③⑤⑦;②④
(3) E→F 略
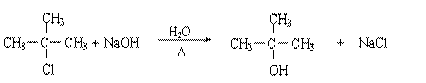
(4)
28(B)
(1) C (1分) (2) 增大 ⅡA ⅤA D > (5分)
(3) 原子失去一个电子后,变为阳离子,再失电子更难,吸收的能量成倍增加。(2分) 七 (1分) 原子核外电子是分层排布的 (1分)
| |