|
高三化学四月随堂考试题(3)
6.下列有关物质结构的叙述,不正确的是
A.含有非极性键的分子不一定是非极性分子
B.分子晶体的熔沸点与共价键的强弱没有直接的关系
C.共价化合物中一定有极性共价键, 离子化合物中可能有极性共价键
D.含离子键的化合物一定是离子化合物,熔融状态时能导电的晶体一定是离子晶体
7.设NA表示阿伏加德罗常数,下列说法正确的是
A、在同温同压下,相同体积的任何气体单质所含的原子数目相同
B、电解硫酸铜溶液,若电解后产生标准状况下O25.6L,则转移的电子数目为2NA
C、室温下,42g乙烯和丙烯的混合气体中含碳原子为3NA
D、1mol镁与足量的氧气或氮气生成MgO或Mg3N2失去电子数分别为2NA和3NA
8.能促进水的电离,并使溶液中c(H )>c(OH−)的操作是①将水加热煮沸 ②向水中投入一小块金属钠 ③向水中通CO2 ④向水中加入明矾晶体 ⑤向水中加入NaHCO3固体 ⑥向水中加NaHSO4固体
A.①②④⑤ B.④ C.③④⑤ D.①④⑤
9.在下列各组反应中,两者反应遵循的化学原理相同的是①KClO3+6HCl 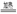 KCl+3Cl2↑+3H2O和2Na2S+3H2SO3 KCl+3Cl2↑+3H2O和2Na2S+3H2SO3  2Na2SO3+3S↓+3H2O②FeCl3溶液中加入HI溶液和FeCl3溶液中加入苯酚溶液③过氧化钠的漂白性和SO2水溶液的漂白性④FeCl3用于净水和明矾净水 2Na2SO3+3S↓+3H2O②FeCl3溶液中加入HI溶液和FeCl3溶液中加入苯酚溶液③过氧化钠的漂白性和SO2水溶液的漂白性④FeCl3用于净水和明矾净水
A.①③ B.②④ C.②③ D.①④
10.下列反应的离子方程式正确的是
 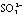 A.偏铝酸钠溶液通入少量SO2气体: +SO2+3H2O ═ 2Al(OH)3↓+ A.偏铝酸钠溶液通入少量SO2气体: +SO2+3H2O ═ 2Al(OH)3↓+
B.硫酸亚铁溶液中加入次氯酸钠溶液:Fe2+ 2ClO-+2H2O ═ Fe(OH)2↓+2HClO
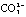 C.用氨水吸收过量的二氧化碳气体:2NH3·H2O+CO2═2NH4+ C.用氨水吸收过量的二氧化碳气体:2NH3·H2O+CO2═2NH4+
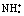  D.硫酸铵溶液中加入氢氧氧化钡溶液: + +Ba2+ OH-═BaSO4↓+NH3·H2O D.硫酸铵溶液中加入氢氧氧化钡溶液: + +Ba2+ OH-═BaSO4↓+NH3·H2O
11.分别在pH=1的一元酸和pH=13的NaOH溶液中加入足量的铝,放出H2的量前者多。下列判定中正确的是:①两溶液体积相同时,酸是强酸;②两溶液体积相同时,酸则是弱酸;③酸溶液的体积一定大于NaOH溶液的体积;④酸是弱酸时,物质的量浓度比NaOH溶液的大。A.②③ B. ②④ C.①③ D. ①④
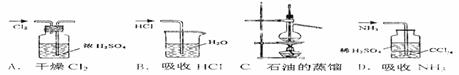
12.用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是
13.钢铁“发蓝”是将钢铁制品浸到某些氧化性的溶液中,在钢铁的表面形成一层四氧化三铁的技术过程。其中一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到130℃反应。其过程可以用如下化学方程式表示
①3Fe NaNO2 5NaOH=3Na2FeO2 H2O NH3↑
②6Na2FeO2 NaNO2 5H2O=3Na2Fe2O4 NH3↑ 7NaOH
③Na2FeO2 Na2Fe2O4 2H2O=Fe3O4 4NaOH 下列说法正确的是
A.反应①不是氧化还原反应 B.该生产过程不产生任何污染
C.反应②中的氧化剂是NaNO2
D.整个反应过程中,每有5.6gFe参加反应转移0.8mol电子
26.(14分)A、B、C、D、E、F六种短周期主族元素,其核电荷数依次增大,已知元素A和C可形成两种常温下均为液体的化合物,B原子最外层电子数是最内层电子数的两倍,A与D、C与F分别处于同一主族且A、D质子数之和是C、F质子数之和的一半,18gE与足量盐酸反应生成标准状况下的H222.4L。 请按要求回答:
(1)由A、C、D三种元素形成的化合物X中含有的化学键类型为 。
(2)A、D、F三种元素形成的化合物Y溶液中的微粒浓度之间存在如下关系(请填写下式中的空白,每空只填一种微粒浓度的符号)。 c(H ) = c(OH—) 。
(3)E、F构成的化合物能与水反应,写出化学方程式 。
(4)①写出单质D与乙醇反应的化学方程式 。
= 2 \* GB3 ②A、B、C三种元素可以形成最简式为A4B2C的有机物,该有机物与足量X水溶液反应得到的两种产物中含有相同数目的B原子。写出该反应的化学方程式 。
(5)A和B组成的化合物M,每个分子中含有18个电子,常温常压下,0.5molM完全燃烧放出780kJ的热量,请写出表示M完全燃烧的热化学方程式 。
27.(13分)中学化学中有很多物质可以实现下 图中物质之间的转化。其中反应条件和部分反应的产物已略去。液体B和C可能是单一溶质的溶液,也可能是纯净物。
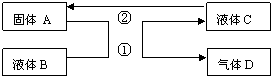 (1)若A是一种紫红色金属,气体 (1)若A是一种紫红色金属,气体
 D能使品红溶液褪色,加热时又恢复 D能使品红溶液褪色,加热时又恢复
原色。写出反应①的化学方程式
。
该气体D与另一种气体H混合后生成一种淡黄色固体W,写出该反应的化学方程
式 。
(2)若A是一种金属单质,D是最轻的气体,B能否是NaOH溶液 (填“能”、“否”)。
(3)若A是金属单质,D是一种无色气体,碰到空气变为红棕色,液体C呈蓝色。
写出反应①的离子方程式 。
写出反应②的任意一个离子方程式 。
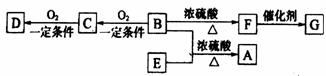 28、(15分)已知有机物A~F有如图转化关系: 28、(15分)已知有机物A~F有如图转化关系:
①A分子式为C10H20O2。②B分子中有两个甲基。③D、E互为具有相同官能团的同分异构体,D能与碳酸氢钠反应放出CO2,E分子烃基上的氢原子若被Cl取代,其一氯代物有3种。④F可以使溴的四氯化碳溶液褪色,G为高分子化合物。(1)B可以发生的反应有 .①取代反应 ②消去反应 ③加聚反应 ④氧化反应
(2)D、F分子所含的官能团的名称依次是 和 。
(3)写出与D、E具有相同官能团的同分异构体的可能结构简式: 。
(4)写出下列转化的化学方程式:
B E→A ;
F→G 。
29.(4分)I、下列实验操作或对实验事实的描述不正确的是 (填序号)
① 将乙烯、乙炔分别通入溴水中,乙炔使溴水的褪色速度快
② 配置硫酸铜溶液时应向溶液中加入少量的铜粉
③ 实验室可以用双氧水和二氧化锰制取少量的氧气
④ 向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
⑤ 向某溶液中先通入Cl2再滴加KSCN溶液时溶液变红,证实该溶液一定含有Fe2
⑥ 将Fe(NO3)2溶液加热蒸发至干并灼烧,最后得到红棕色粉末
⑦ 分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多
⑧在试管中放入几片碎滤纸,滴几滴90%的浓硫酸,再将滤纸捣成糊状,微热并冷却后先滴入几滴CuSO4溶液再加入过量的NaOH溶液加热至沸腾,可观察到红色沉淀生成
II、(14分)某化学小组模拟工业生产制取HNO3,设计下图所示装置,其中a为一个可持续鼓入空气的橡皮球。请回答下列问题:
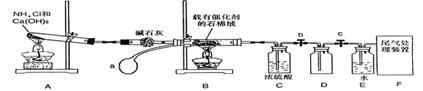
(1)写出装置A中主要反应的化学方程式 。
(2)已知1molNO2与液态水反应生成HNO3溶液和NO气体放出热量46kJ,写出该反应的热化学方程式 。
该反应是一个可逆反应,欲要提高NO2的转化率,可采取的措施是 。
A.降低温度 B.升高温度 C.减小压强 D.增大压强
(3)实验结束后,关闭止水夹b、c,将装置D,浸入冰水中,现象是
(4)装置C中浓H2SO4的作用是 。
(5)请你帮助该化学小组设计实验室制取NH3的另一方案
(6)干燥管中的碱石灰用于干燥NH3,某同学思考是否可用无水
氯化钙代替碱石灰,并设计右图所示装置(仪器固定装置省略未画)
进行验证。实验步骤如下:①用烧瓶收集满干燥的氨气,立即塞上如
图的示的橡胶塞。②正立烧瓶,使无水氯化钙固体滑入烧瓶底部,摇动,可观察到的现象是 ,由此,该同学得出结论:不能用CaCl2代替石灰。
附加题:
1.铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu HNO3 → Cu(NO3)2 NO↑ NO2↑ H2O (方程式未配平)
(1) 硝酸在该反应中的作用是 ,该反应的还原产物是 。
(2) 0.3mol Cu被硝酸完全溶解后,Cu失去的电子数是__________ 个,假如得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是 ,若用排水法收集这些气体,可得标准状况下的气体体积 。
(3) 假如参加反应的Cu和HNO3的物质的量之比是3:10,写出并配平该反应的离子方程式____________。
(4) 假如没有对该反应中的某些物质的比例作限定,则方程式可能的配平系数有许多组。原因是____________________。
2. A、B、C、D、E、F、G是由短周期元素组成的七种物质,其中B、C、F是单质;常温下B、C、E为气体;A物质的焰色反应呈黄色。(下图中反应②的部分产物未表示出来。) |
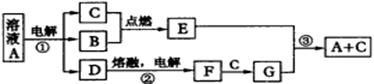
| |
各物质间的转化关系 | |