|
本卷满分108分,考试时间90分钟。
可能采用的相对原子质量:H-1,C-12,N-14,O-16, Ca-40
一、选择(每小题3分,共48分。每小题只有一个选项符合题意。)
1.下列产品的使用不会对环境造成污染的是
A.含磷洗衣粉 B.酒精 C.氟里昂 D.含汞电池
2.据报道,月球上有大量3He存在,以下关于3He的说法正确的是
A.是4He的同分异构体 B.比4He多一个中子
C.是4He的同位素 D.比4He少一个质子
3.下列实验中,仪器的下端必须插入液面下的是
①制备氢气的简易装置中的长颈漏斗; ②制备氯气装置中的分液漏斗;
③制备Fe(OH)2操作中的胶头滴管; ④将氯化氢气体溶于水时的导管
⑤用乙醇制取乙烯时的温度计; ⑥分馏石油时的温度计
A ①③④⑤ B ②④⑥ C ①③⑤ D 全部
4.设NA为阿佛加德罗常数。下列叙述中正确的是
A.46gNO2和N2O4混合气体中含有原子数为3NA
B.标准状况下22.4LH2中含中子数为2NA
C.1L1mol/L醋酸溶液中离子总数为2NA
D.1 molH2O2完全分解时转移电子2NA个
5.X、Y是元素周期表ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来
6.用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为Vl和V2,则Vl和V2的关系正确的是
A.V1>V2 B.V1<V2 C.V1=V2 D.V1≤ V2
7.类推的思维方式在化学学习与研究中经常采用,但类推出的结论是否正确最终要经过实践的验证。以下类推的结论正确的是
A.由甲酸可以发生银镜反应可推出其余的羧酸也均能发生银镜反应
B.NaCl与CsCl化学式相似,故NaCl与CsCl的晶体结构也相似
C.由“2Fe 3Cl2=2FeCl3”反应可推出“2Fe 3I2=2FeI3”反应也能发生
D.Na、K具有强还原性,Na常温下与水剧烈反应,故K常温下也能与水剧烈反应
8.下列溶液暴露于空气中,开始一段时间其pH变小的是(不考虑溶质挥发)
①H2S ②H2SO3 ③Na2S ④Ca(OH)2 ⑤氯水 ⑥Na2SO3
A.①②④ B.②⑤⑥
C.①②④⑤ D.②④⑤⑥
9.A和M为两种元素,已知A位于短周期,且A2—与M 的电子数之差为8,则下列说法中正确的是
A.A和M的原子序数之差为8
B.A和M原子的电子总数之和可能是11
C.A和M原子的最外层电子数之和为8
D.A和M原子的最外层电子数之差为7
10.一定能在下列溶液中大量共存的离子组是
A.含有大量Al3 的溶液:Na 、NH4 、SO42—、Cl—
B.c(H )=1×10—13mol·L—1的溶液:Na 、Ca2 、SO42—、CO32—
C.含有大量Fe3 的溶液:Na 、Mg2 、NO3—、SCN—
D.含有大量NO3—的溶液:H 、Fe2 、SO42—、Cl—
11.下列反应的离子方程式错误的是
A. 碳酸钙跟稀盐酸反应:CO32— 2H =CO2↑ H2O
B.铁跟氯化铁溶液反应:Fe 2Fe3 =3Fe2
C.铜跟浓硝酸反应:Cu 2NO3— 4H =Cu2 2NO2↑ 2H2O
D.铁跟稀硫酸反应:Fe 2H =Fe2 H2↑
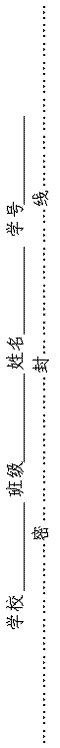 12.将反应Mn2++BiO3-+H+→MnO4-+Bi3++H2O配平后 12.将反应Mn2++BiO3-+H+→MnO4-+Bi3++H2O配平后 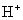 的化学计量数为 A、8 B、10 C、14 D、30 的化学计量数为 A、8 B、10 C、14 D、30
13.下列有关说法中,错误的是
A、NH4H是一种离子晶体,其中氢离子的核外电子排布与氦原子相同
B、在石墨晶体中,碳原子与共价键的个数比为2:3
C、三种氢化物的沸点高低:HBr>HCl>HF
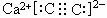 D、CaC2的电子式为 D、CaC2的电子式为
14.下列热化学方程式中△H的绝对值能表示可燃物的燃烧热的是
A.H2(g) C12(g)=2HCl(g);△H = -184.6kJ/mol
B.CH4(g) 2O2(g)=CO2(g) 2H2O(g);△H == -802.3kJ/mol
C.2H2(g) O2(g)=2H2O(1);△H == -571.6kJ/mol
D.CO(g) 1/2O2(g)=CO2(g);△H = -283kJ/mol
15.关于某无色溶液中所含离子的鉴别,下列判定正确的是
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在
B.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在
C.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32-
16.某学生欲完成2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的是:
一、选择答案
|
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
二、(本题包括3小题,共33分)
17.(10分)A、B、C、D、E是相邻三个周期中的五种元素,它们的原子序数依次增大,B、C、D属同一周期,A、E在周期表中处于同一纵行.已知:①除A外,各元素原子的内层均已填满电子,其中B的最外层有4个电子;②A与B,B与C都能生成气态非极性分子的化合物;③D与E生成离子化合物,其离子的电子层结构相同.回答:
(1)A为________元素(填名称,下同),B为_______元素, D为_______元素,
(2)C元素在周期表中属第________周期,________族元素;
(3)D与B形成的化合物的电子式______ ,属________晶体;
(4)C与E形成的化合物的电子式为___________和___________,属______晶体.
18.(10分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应: N2(g) 3H2(g)  2NH3(g) 2NH3(g)
(1) 若反应进行到某时刻 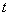 时, 时, 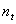 (N2)=13 mol, (N2)=13 mol, 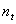 (NH3)=6 mol,则a= (NH3)=6 mol,则a=
(2) 反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量 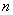 (NH3)= (NH3)=
(3) 原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),
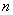 (始): (始): 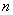 (平)=________________。 (平)=________________。
(4) 达到平衡时,N2和H2的转化率之比, 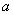 (N2): (N2): 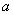 (H2)_______。 (H2)_______。
(5) 平衡混合气体中, 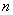 (N2): (N2): 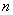 (H2): (H2): 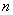 (NH3)_____________。 (NH3)_____________。 19.(11分)不同卤素原子间可以通过共用电子对,形成卤素互化物,其通式为:XX′n(n = 1,3,5,7;且非金属性X′>X)。卤素互化物的结构性质与卤素单质相似。回答下列问题:
(1)在IBr中碘元素的化合价是 ,IBr应属于 晶体。IBr与氢氧化钠溶液反应的离子方程式是 。
(2)在所有卤素互化物中,沸点最低的应是 (写分子式,下同)。
(3)若n = 7,则最可能生成的卤素互化物应为 。
(4)某卤素互化物与水的反应为 ClFn H2O → HClO3 Cl2 O2 HF,若ClFn与H2O的物质的量之比为3∶5,则n= 。
三、本题8分
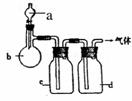 20.(8分)拟用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。 20.(8分)拟用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。
|
气体 |
a |
b |
c |
d | |
CO2 |
盐酸 |
CaCO3 |
饱和Na2CO3溶液 |
浓硫酸 | |
Cl2 |
浓盐酸 |
MnO2 |
NaOH溶液 |
浓硫酸 | |
NH3 |
饱和NH4Cl溶液 |
消石灰 |
H2O |
固体NaOH | |
NO |
稀HNO3 |
铜屑 |
H2O |
P2O5 | |