(满分100分,考试时间100分钟)
一、选择题(每题只有1个正确答案,每题1分)
1.等质量的下列物质,所含分子数最多的是( )
A.KCl B.CH3COOH C.SiO2 D.P4
2.如果测得a g水中含有n个氢原子,则阿伏加德罗常数的数值为( )
A.9n/a B.a/9n C.a/18n D.18n/a
3.任何酸溶液都具有的性质是( )
A.能与纯碱反应并生成CO2 B.能与锌反应并生成H2
C.能使甲基橙试液变红 D.能与烧碱起中和反应
4.一种比黄金贵百倍的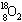 气体,在兰州近代物理研究所制备成功。1 mol
气体,在兰州近代物理研究所制备成功。1 mol 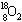 气体中所含中子的物质的量为( )
气体中所含中子的物质的量为( )
A.36 mol B.20 mol C.16 mol D.10 mol
5.下列各叙述中正确的是( )
①元素的相对原子质量是该元素的质量与原子质量的的比值;②质子数相同的微粒均属于同一种元素;③分子是保持物质性质的一种微粒;④原子是物质变化中的最小微粒;⑤同一种元素组成的单质是纯净物;⑥原电池是把化学能转变为电能的装置;⑦有新单质生成的化学反应不一定是氧化还原反应
A.都不正确 B.只有①②⑤⑥⑦正确
C.只有①②③④⑤正确 D.只有⑥⑦正确
二、选择题(每题有1~2个正确答案,每题2分)
6.若向无色透明的溶液中加入铝粉,反应后生成氢气,则原溶液肯定不存在的离子组是( )
A.Cl-、NO3-、Mg2+、K+ B.NH4+、Cl-、Na+、Ba2+
C.SO42-、Cl-、CO32-、Na+ D.SO42-、K+、S2O32-、NH4+
7.3.2 g铜与过量30 mL 8 mol·L-1浓硝酸充分反应,硝酸的还原产物有NO和NO2。反应后溶液中含H+ a mol,则此时溶液所含NO3-的物质的量为( )
A.a mol B.(a+0.1) mol C.0.1 mol D.(1-a) mol
8.下列说法正确的是(N0表示阿伏加德罗常数的数值)( )
A.28 g氮气含有的原子数目为N0
B.4 g金属钙变成钙离子时失去的电子数目为0.1N0
C.1 mol甲烷的质量与N0个甲烷分子的质量之和相等
D.在标准状况下,22.4 L甲烷和乙炔混合物所含分子数为N0
9.下列电子式书写正确的是( )
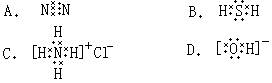
10.在b L FeBr2溶液中通入a mol氯气时,使溶液中50%的Br-被氧化为Br2,则原溶液中FeBr2的物质的量浓度是( )
A.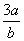 mol·L-1 B.
mol·L-1 B.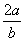 mol·L-1 C.
mol·L-1 C.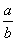 mol·L-1 D.
mol·L-1 D. 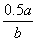 mol·L-1
mol·L-1
11.G、Q、X、Y、Z均为氯的含氧化合物。我们不了解它们的分子式(或化学式),但知道它们在一定条件下具有如下的转换关系(未配平):
(1)G→Q+NaCl
(2)Q+H2O X+H2
X+H2
(3)Y+NaOH→G+Q+H2O
(4)Z+NaOH→Q+X+H2O
这五种化合物中氯的化合价由低到高的顺序为( )
A.QGZYX B.GYQZX C.GYZQX D.ZXGYQ
12.在一定温度下,将a g物质放入b g H2O中全部溶解,所得溶液中溶质的质量分数是( )
A.大于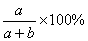 B.等于
B.等于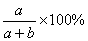
C.小于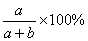 D.前三者均有可能
D.前三者均有可能
13.硼的含氧酸的分子式不可能是( )
A.HBO2 B.H3BO3 C.H2BO4 D.H2B4O7
14.如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是(N0表示阿伏加德罗常数的数值)( )
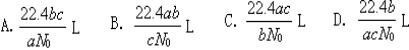
15.设N0代表阿伏加德罗常数的数值,则关于热化学方程式C2H2(气)+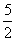 O2(气)==2CO2(气)+H2O(液)+1300 kJ的说法中,正确的是( )
O2(气)==2CO2(气)+H2O(液)+1300 kJ的说法中,正确的是( )
A.有10N0个电子转移时,放出1300 kJ的能量
B.有 N0个水分子生成且为液体时,吸收1300 kJ的能量
C.有2N0个碳氧共用电子对生成时,放出1300 kJ的能量
D.有8N0个碳氧共用电子对生成时,放出1300 kJ的能量
16.下列反应的离子方程式正确的是( )
A.NaHS水解:HS-+H2O H3O++S2-
H3O++S2-
B.钠与CuSO4溶液反应:2Na+Cu2+==Cu+2Na+
C.向CaCl2溶液中通入少量CO2气体:Ca2++CO2+H2O==CaCO3↓+2H+
D.澄清石灰水跟盐酸反应:H++OH-==H2O
17.一份K2CO3样品中含Na2CO3、KNO3、Ba(NO3)2三种杂质中的一种或两种。把7.8 g样品溶于足量水中得到澄清溶液,再加入过量的CaCl2溶液,可得到5.0 g沉淀,则原样品中所含的杂质( )
A. 有Na2CO3,没有Ba(NO3)2
B.肯定有KNO3,没有Ba(NO3)2,可能还有Na2CO3
C.肯定没有Na2CO3和Ba(NO3)2
D.无法确定
18.有X、Y、Z、W四种金属,已知X(OH)3的碱性大于Y(OH)3的碱性,X3+可使Z氧化,W可与热水反应产生H2,X不能与热水反应,把X的金属片插入稀硫酸,让金属丝Z与X接触,则X的溶解速率加快。这四种金属活动性强弱的关系一定是( )
A.X>Y B.Z>Y C.W>Z D.Z>X
19.依照阿伏加德罗定律,下列叙述中正确的是( )
A.同温同压下两种气体的体积之比等于摩尔质量之比
B. 同温同压下两种气体的物质的量之比等于密度之比
C. 同温同压下两种气体的摩尔质量之比等于密度之比
D.同温同体积下两种气体的物质的量之比等于压强之比
20.分别取等质量80 ℃的甲、乙两种化合物的饱和溶液,降温至20 ℃后,所析出的甲的质量比乙的大(甲和乙均不含结晶水)。下列关于甲、乙溶解度的叙述中肯定正确的是( )
A.20 ℃时,乙的溶解度比甲的大 B.80 ℃时,甲的溶解度比乙的大
C.温度对乙的溶解度影响较大 D.温度对甲的溶解度影响较大
三、选择题(每题只有一个正确答案,每题3分)
21.乙二酸俗称草酸,具有还原性,用0.1 mol·L-1的草酸溶液20 mL,恰好将4×10-3 mol的VO2+还原,则在还原产物VOn+中,n值为( )
A.5 B.4 C.3 D.2
22.将30 ℃时含A的溶液136 g分成两等份,向其中一份中加入2 g A就不再溶解;将另一份溶液降温至0 ℃,析出A 5.5 g,此时溶液中溶质的质量分数为20%,则A在30 ℃时的溶解度为( )
A.20 g B.30 g C.40 g D.50 g
23.将m1 g锌加到m2 g 20% HCl 溶液中去,反应结果共放出n L H2(标准状况),则被还原的HCl的物质的量是( )
A. 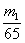 mol B.
mol B.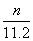 mol C.
mol C.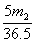 mol D.
mol D.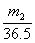 mol
mol
24.向100 mL 0.25 mol·L-1的AlCl3溶液中,加入金属钠,恰好完全反应,形成只含有NaCl和NaAlO2的澄清溶液,则加入钠的物质的量应是( )
A.0.025 mol B.0.05 mol C.0.1 mol D.0.25 mol
25.下列几种方法制备O2:①KClO3 和MnO2共热;②Na2O2加水;③H2O2中加MnO2;④KMnO4受热分解。若要制相同质量的O2,则上述反应中相关物质转移的电子数之比为( )
A.3:2:2:4 B.1:1:1:1 C.2:1:1:2 D.1:2:1:2
四、填空题(每空2分)
26.19世纪初,英国科学家___________提出了近代原子学说,意大利科学家____________首先提出了分子的概念。(共2分)
27.写出由化合反应一步制取FeCl2的化学反应方程式:
________________________________________________
28.如果Fe3O4可写作FeO·Fe2O3或FeFe2O4,与此类似,Pb3O4则可写作___________或______________。(共2分)
29.有人认为实验室中氯酸钾与黑色氧化物E在高温条件下的反应分下列三步进行:2KClO3+2E==2A+B+C;2A==D+E+C;D+B==2KCl+E+C。从中可见物质E的作用是_______;B是一种气态单质,它是_____气;A溶液的颜色是_______色;D的化学式是___________。(共4分)
30.(1)在a mL BaCl2溶液中加入0.05 mol·L-1一定体积的H2SO4溶液时,两者恰好完全反应,且反应后溶液的pH为3.0,若溶液混合后体积不变,则溶液中BaCl2的物质的量浓度为____________________。
(2)将3.1 g红磷置于14.2 g Cl2中充分燃烧,反应完全后生成物PCl3和PCl5的物质的量之比为_________________。
(3)高锰酸钾和氢溴酸溶液可以发生下列反应:KMnO4+HBr®Br2+MnBr2+KBr+H2O
其中还原剂是 。若消耗0.1 mol氧化剂,则被氧化的还原剂的物质的量是 。
五、填空题(每空2分)
31.Fe3+在溶液中能将I-氧化,如果溶液中有大量F-存在,Fe3+则与F-结合成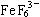 ;而不能氧化I-,由此可以证明:
;而不能氧化I-,由此可以证明:
(1)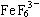 的电离度_____________(填“大”或“小”);
的电离度_____________(填“大”或“小”);
(2)Fe3+的氧化性由于何原因而变弱:_____________________________;
(3)强酸性条件下,将FeCl3、KI、NaF三种溶液混合,仍有I2生成,其原因是_____________________________________________________。
32.(1)长期以来一直认为氟的含氧酸不存在。自1971年美国科学家用F2通过细冰末获得HFO(次氟酸)以来,人们对HFO的研究引起了充分重视。
①HFO的电子式为________________
②次氟酸能于水反应得到溶液A,A中含有B、C二种溶质。B常用于雕刻玻璃,C在二氧化锰催化作用下能迅速分解生成一种能使带火星木条复燃的气体。次氟酸与水反应的化学方程式为:_____________________________________________________。
③将A溶液滴入紫色酸性高锰酸钾溶液中,溶液紫色逐渐褪去。完成并配平此离子方程式:
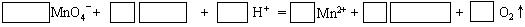
(2)1986年,化学上第一次用非电解法制得氟气,试配平该反应的化学方程式:

反应中____________元素被还原。
六、简答题(每题3分)
33.试设计一个实验,证明氧化锌是一种两性氧化物。
34.某同学配置好两瓶Na2SO4溶液,一瓶为饱和溶液,另一瓶为 0.1 mol·L-1的非饱和溶液,还没来得及贴上标签就搞混了。区别这两种溶液最简单的方法是什么?
七、计算题(共12分)
35.将70 g过氧化钠和氧化钠的混和物跟98 g水充分反应后,所得氢氧化钠溶液中溶质的质量分数为50%。试分别写出过氧化钠和氧化钠跟水反应的化学方程式,并计算原混和物中过氧化钠和氧化钠的质量各为多少?
36.本题相对分子质量用以下数据:H2O:18.0 CaO:56.0 CaO2:72.0
过氧化钙是一种安全无毒的氧化物,通常含有部分CaO,且带有数量不等的结晶水。为分析某过氧化物样品的组成,进行了如下实验。
①称取0.270 g样品,灼热使之完全分解,生成CaO、O2和H2O,得到的O2在标准状况下的体积为33.6 mL。
②另取0.120 g样品,溶于稀盐酸,加热煮沸使生成的H2O2完全分解。然后将溶液中的Ca2+完全转化成CaC2O4沉淀,经过滤洗涤后,将沉淀溶于热的稀硫酸,用0.0200 mol·L-1 KMnO4溶液滴定,共用去31.0 mL KMnO4溶液。化学方程式如下:
5CaC2O4+2KMnO4+8H2SO4=K2SO4+2MnSO4+5CaSO4+10CO2+8H2O
(1)写出CaO2受热分解的化学方程式。
(2)计算样品中CaO2的质量分数。
(3)计算样品中CaO2·xH2O的x值。