| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
⑴溶液A中加入NaClO的目的是 ; ⑵在溶液B中加入CuO的作用是 ; ⑶操作a的目的是 ; ⑷在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2过程中,采取稍多量盐酸和低温蒸干措施的目的是 。 四、(本题包括2小题) 19.(8分)在加热条件下发生某一化学反应,现对反应体系内的X、Y、Z、Q四种物质进行 测定,测得如下数据:
| 物质
| X
| Y
| Z
| Q
| 反应前质量/g
| 40.0
| 2.3
| 37.8
| 0.0
| 反应后质量/g
| 43.6
| 待测数据
| 12.6
| 3.2 |
请回答下列问题:
(1)(4分)上表中“待测数据”的数值是多少_______,此密闭容器内发生的反应属于______________(填基本反应类型)。
(2)(4分)若X是水,Y是氮的氧化物,且反应式的计量系数比是n(X):n(Y):n(Z):n(Q)=2:4:4:1,则该反应的化学方程式为____________________________。
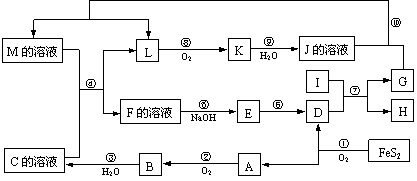
20.(12分)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,A是具有刺激性气味的气体,I是由地壳中含量最高的金属元素形成的单质,K是一种红棕色气体,D是一种红棕色粉末,常用作红色油漆和涂料。
|
M的溶液 |
|
⑤ NaOH |
|
C的溶液 |
|
L |
|
K |
|
J的溶液 |
|
F的溶液 |
|
E |
|
I |
|
D |
|
G |
|
H |
|
B |
|
A |
|
FeS2 |
|
④ |
|
③ H2O |
|
② O2 |
|
① O2 |
|
⑥ |
|
⑦ |
|
⑩ |
|
⑨ H2O |
|
⑧ O2 |
 |
请填写下列空白:
⑴在周期表中,组成单质G的元素位于第______周期______族。
⑵在反应⑨中还原剂与氧化剂的物质的量之比为___________________。
⑶在反应②、③、⑥、⑧中,既属于化合反应又属于氧化还原反应的是_________(填写序号)。
⑷反应④的离子方程式是:_______________________________________。
⑸将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是:_____________________。
五、(本题包括2小题)
21.(7分)到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源。
⑴化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关。
已知:H2(g)+Cl2(g)=2HCl(g) △H=-185kJ/mol
E(H-H)=436 kJ/mol,E(Cl-Cl)=247 kJ/mol
则E(H-Cl)= kJ·mol-1;
⑵已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-25kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+19kJ/mol
请写出CO还原FeO的热化学方程式: ;
22.(13分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
|
SiO2 C N2 Si3N4 CO |
|
高温 |
⑴配平上述反应的化学方程式(将化学计量数填在方框内)并用单线桥法表示电子转移的方向和数目;
⑵该反应的氧化剂是 ,其还原产物是 ;
⑶该反应的平衡常数表达式为K= ;
⑷若知上述反应为放热反应,则其反应热△H 零(填“>”、“<”或“=”;升高温度,其平衡常数值 (填“增大”、“减小”或“不变”);
⑸若使压强增大,则上述平衡向 反应方向移动(填“正”或“逆”);
⑹若已知CO生成速率为v(CO)=18mol/(L·min),则N2消耗速速率为v(N2)= mol/(L·min)。
六、(10分)
23-A.酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:
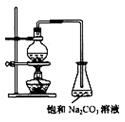 CH3COOH+C2H5OH
CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有 、
等。
(2) 若用右图所示装置来制备少量的乙酸乙酯,产率往往偏低,
其原因可能为 、
等。
(3)此反应以浓硫酸为催化剂,可能会造成 、 等问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,
且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)
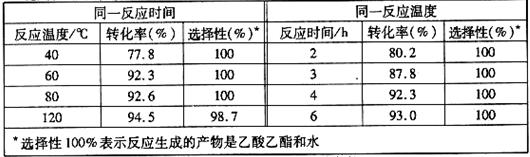
①根据表中数据,下列 (填字母)为该反应的最佳条件。
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h
② 当反应温度达到120℃时,反应选择性降低的原因可能为
|
班级 姓名 考场 考号 …………………………………………密……………………………封……………………………………线………………………………… |
 高三第二次月考化学试题答题纸
高三第二次月考化学试题答题纸
注重事项
1. 答题前,考生将自己的姓名、考场、考号填写清楚,并认真核对姓名、考号及科目。
2. 在草稿纸、试题卷上答题无效。
3. 保持字体工整,笔迹清楚,卡面清洁,不折叠。
选择题(涂卡)
题号
1
2
3
4
5
6
7
8
答案
题号
9
10
11
12
13
14
15
16
答案
非
选择题
答题说明:除作图可使用2B铅笔外,其余各题请按题号用0.5mm黑色签字笔书写,否则作答无效。
17.⑴ 。⑵ 。
⑶① , 。
② , ,
。
③ 。 ④ 。
18.⑴ ;
⑵ ;
⑶ ;
⑷ 。
19.⑴ , ;⑵ ;
20.⑴第___ ___周期__ ____族。⑵之比为___________________。
⑶__ __ __ ___。⑷ 。
⑸____________________________________________________________。
请在各题规定的区域内答题,超出该区域的答案无效!
21.⑴E(H-Cl)= ;
⑵ ;
|
SiO2 C N2 Si3N4 CO |
|
高温 |
⑵ , ;
⑶K= ;⑷△H 零;
⑸
⑹v(N2)= mol/(L·min)。
23-A.⑴ , 。
⑵ , 。
⑶ , 。
⑷① ;② 。
请在各题规定的区域内答题,超出该区域的答案无效!
高三化学月考4参考答案
题号
1
2
3
4
5
6
7
8
答案
A
D
C
B
C
D
A
B
题号
9
10
11
12
13
14
15
16
答案
C
AD
B
C
BD
A
B
AC
|
高温 |
|
SiO2 2C = Si 2CO |
17.⑴ ⑵蒸馏 ⑶①浓硫酸 使滴入烧瓶中的SiHCl3汽化
|
H2 SiHCl3 Si 3HCl |
|
1000~1100℃ |
③排尽装置中的空气(其它合理答案也可酌情给分)。 ④bd
18.⑴将Fe2+氧化为Fe3+而使分离更加完全
⑵调节溶液的pH为3~4,使Fe3+完全转变为Fe(OH)3沉淀而分离Fe3+
⑶洗涤Cu(OH)2表面的可溶性杂质
⑷抑制Cu2+的水解
19.(1)20.7 分解反应 (2)4HNO3 ![]() 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
20.⑴四 Ⅷ ⑵2:1 ⑶②⑧
⑷3Fe2+ NO3- 4H+ = 3Fe3+ NO↑ 2H2O
⑸Fe2O3 3KNO3 4KOH = 2K2FeO4 3KNO2 2H2O
21.⑴434
|
c6(CO) |
|
c2(N2) |
|
K= |
22.⑴3,6,2,1,6 ⑵N2,Si3N4 ⑶
⑷<;减小 ⑸逆 ⑹6
23.
(l)增大乙醇的浓度 移去生成物
(2)原料来不及反应就被蒸出 温度过高,发生了副反应 冷凝效果不好,部分产物挥发了
(任填两种)
(3)产生大量的酸性废液(或造成环境污染) 部分原料炭化 催化剂重复使用困难催化效果不理想(任填两种)
(4)① C ②乙醇脱水生成了乙醚
| |