| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
(1)上述元素的单质中熔点最高的可能是 _____(填字母)。 (2)在一定条件下, (3)现有另一种元素,其原子获得一个电子所释放出能量是上表中所列元素中最大的,则X是周期表中_________族元素。 (4)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的_______(填字母)元素组成的,飞船中需要制造一种适合航天员生存的人工生态环境,还应该在氧气中充入一种稀释气体,该气体分子式为________。在运送飞船的火箭推进器中盛有分别由ae和af元素组成的两种液态化合物,它们的分子皆为18电子微粒,当它们混合反应时即产生e的单质和a2f。请写出该反应的化学方程式为____________________________。这个反应应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点是______________________________________________。 24.在上海召开的第7届全球人类基因组大会上,我国科学家第一次提出可以用砒霜(As2O3)来治疗早期性幼粒白血病。已知砒霜具有两性。 (1)完成并配平下列化学反应方程式: ___ As2O3 ___ Zn ___ H2SO4 →___ AsH3 ___ ZnSO4 ___ ___________ (2)As2O3在上述反应中显示出来的性质是___________,H2SO4显示出来的性质是_____________(均填写编号) ①氧化性 ②还原性 ③酸性 ④碱性 (3)AsH3又称为胂。生产0.1mol胂,则转移电子的物质的量为__________mol (4)砷原子最外层电子排布式为___________。在AsH3、PH3 、H2S三种物质中,最不稳定的是____________________ (5)砒霜在烧碱溶液中反应的离子方程式为________________________________ 25.500℃、20 MPa时,将H2和N2置于一容积为2 L的密闭容器中发生
成下列各题: ( 1 ) 反应达到平衡时,平衡常数表达式 K=___________________ 此时增加N2的量,平衡常数将______________(填“增大”“减小” 或 “不变”) ( 2 ) 500℃、20 MPa时,反应处于平衡状态的时间___________ ___________________________ 。 ( 3 ) 反应开始到第一次平衡时,N2的平均反应速率为________________。 ( 4 ) 据图判定,反应进行到10 min至20 min时曲线发生变化的原因是:____ __________________反应进行至25min时,曲线发生变化的原因是_____________________________________________ 五.(本题共24分) 26.某化学课外爱好小组探究铜跟浓硫酸的反应情况: 取6.4g铜片和10ml 18mol/L浓硫酸放在圆底烧瓶中共热,直至反应完毕,最后发现烧瓶中还有铜片剩余,同时他们根据所学的化学知识认为还有较多的硫酸剩余。 (1)请写出铜跟浓硫酸反应的化学方程式:____________________________________________。试问:为什么较多的余酸不与铜继续反应?简述理由:_________________________________________ (2)可以证实有余酸的实验方案一是___________。(填写字母编号,多选扣分) A、再加入足量镁粉 B、再滴入BaCl2溶液 C、再加入银粉 D、再滴入Na2CO3溶液 在上述可证实存在余酸的实验方案中,继续通过测定生成气体的量即可确定余酸的浓度,测定方法有多种,方法①_____________________________②___________________________________ (3)可以证实有余酸的实验方案二是:测定反应后混合溶液中Cu2 的量。在反应后的溶液中加蒸馏水稀释至100ml,加入足量Na2S溶液,充分反应后,过滤出沉淀,洗涤,干燥,称量为A克。 写出生成沉淀的离子反应方程式:_____________________________。假如在反应后的溶液中直接加入足量Na2S溶液,充分反应后,,过滤出沉淀,洗涤,干燥,称量为B克,则B可能_________A(填写“大于”“小于”或“等于”),用化学方程式说明原因____________________________________。 (4)上述实验方案中,能够计算余酸浓度的数据除测算产生气体的物质的量或反应掉铜的物质的量外,尚缺少的测量数据是_________________________________________________ 27.在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
  SHAPE \* MERGEFORMAT SHAPE \* MERGEFORMAT
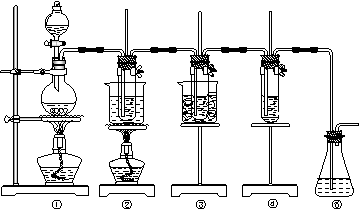 
图中: = 1 \* GB3 ①为氯气发生装置; = 2 \* GB3 ②的试管里盛有15 mL 30% KOH溶液,并置于热水浴中; = 3 \* GB3 ③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中; = 4 \* GB3 ④的试管里加有紫色石蕊试液; 请填写下列空白: (1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在 = 1 \* GB3 ①与 = 2 \* GB3 ②之间安装盛有________或_________(填写化学试剂名称)的净化装置。 (2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:______________________________________。 = 2 \* GB3 ②的试管中反应的离子方程式为___________________________。反应完毕经冷却后, = 2 \* GB3 ②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是_______(填写编号字母);从 = 2 \* GB3 ②的试管中分离出该晶体的方法是__________(填写实验操作名称)。
(3)实验中可观察到 = 4 \* GB3 ④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
(4)有同学指出该实验装置存在明显不妥之处,请在原实验装置图上作图完善,说明使用何种化学试剂,理由__________________________________________________________ 六.(本题共20分) 28.近日,油炸薯条再次出现食品安全危机,因为其中反式脂肪酸(trans fatty acids简称TFA)的含量增加了1/3。中国食疗网发布“反式脂肪酸预警报告”,报告称:摄入过多的反式脂肪酸,轻易堵塞血管而导致心脑血管疾病。顺式脂肪酸、反式脂肪酸的结构如图所示。
试回答下列问题: (1)顺(反)式脂肪酸中所含官能团名称是 。 (2)与上述顺(反)式脂肪酸互为同系物的最简单物质的结构简式为_____________。 (3)上述顺式脂肪酸和反式脂肪酸都能与H2在一定条件下发生氢化反应,其产物关系为 。 A.同分异构体 B.同系物 C.同一种物质 D.同素异形体 (4)研究表明,在特定的条件下,顺式脂肪酸与反式脂肪酸会产生互变,油脂长时间高温加热及油脂催化加氢都会使反式脂肪酸的含量增高。亚油酸(9,12-十八碳二烯酸)与氢气以1∶1催化加氢过程中,考虑顺、反异构,生成的脂肪酸最多有 种。 (5)据专家介绍,多食用花生油对人体有益,是因为花生油中含反式脂肪酸较少,且含有对人体有益的白藜芦醇(化学名称为芪三酚),其结构简式为: 试写出1mol白藜芦醇与足量溴水发生反应的化学方程式: 。 29.克矽平是一种治疗矽肺病的药物,其合成路线如下(反应均在一定条件下进行):
(1)化合物Ⅰ的某些性质类似苯。例如,化合物Ⅰ可以在一定条件下与氢气发生加成反应生成
,其反应方程式为 (不要求标出反应条件) (2)化合物I生成化合物Ⅱ是原子利用率100%的反应,所需另一种反应物的分子式为 (3)下列关于化合物Ⅱ和化合物Ⅲ的化学性质,说法正确的是 (填字母) A.化合物Ⅱ可以与CH3COOH发生酯化反应 B.化合物Ⅱ不可以与金属钠反应生成氢气 C.化合物Ⅲ可以使溴的四氯化碳溶液褪色 D.化合物Ⅲ不可以使酸性高锰酸钾溶液褪色 (4)化合物Ⅲ生成化合物Ⅳ的反应方程式为 (不要求标出反应条件) (5)用氧化剂氧化化合物Ⅳ生成克矽平和水,则该氧化剂为 。 七.(本题共16分) 30.目前一种新型抗酸剂能迅速改善和缓解胃酸过多的症状,它主要由碳酸镁、氢氧化镁和氢氧化铝组成。现按如下步骤测定药剂中三种主要成分的配比: ⑴取药剂样品,研磨后,加入50mL3.6 mol·L—1盐酸,正好完全反应并收集得到标准状况下224mL气体 ⑵过滤,弃去其中不溶性物质(其余成分不参与反应) ⑶取⑵中滤液,加入足量的NaOH溶液后,过滤、洗涤、灼烧,所得固体2.4g。 试求该药剂中三种主要成分的物质的量之比。 31、某污水处理厂用化学和生物方法处理污水,若污水中所含糖类((CH2O)n)有45%被完全氧化,即发生反应(CH2O)n nO2 → nCO2 nH2O;另有10%经过发酵过程进行无氧分解,即2(CH2O)n→ nCO2 nCH4。其余部分糖类仍然留在沉积物中。当该厂天天生产CO2和CH4共16.0m3(标准状况)时,求 (1)天天被氧化和被发酵的糖类共多少千克? (2)天天有多少千克糖类留在沉积物中? (3)污水中的糖类通过完全氧化、无氧发酵和沉积下来得以处理,使水体得以消除糖类引起的污染。若污水中糖类含量为250mg·m-3,该工厂天天可处理多少立方米污水? (4)生成的CH4可用来生产水煤气:CH4 H2O
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |