|
高三化学上册第13周测试题
可能用到的原子量: H: 1 O: 16 N: 14 Na: 23 Cl: 35.5 C: 12 K: 39 Al:27
S: 32 Fe: 56 Mg: 24 Cu: 64
一、选择题(下列各题只有一个选项符合题意。每小题3分,共60分。
1.下列分子中所有原子均满足最外层8电子结构的是( )
A.LiCl B.NCl3 C.PCl5 D.BF3
2.1999年曾报导合成和分离了含高能量的正离子N5+的化合物N5AsF6,下列叙述错误的是( )
A.N5+共有34个核外电子 B.N5+中氮氮原子间以共用电子对结合
C.化合物N5AsF6中As化合价为 1 D.化合物N5AsF6中F化合价为-1
3.下列说法中正确的是 ( )
A.次外层电子数是2或8或18的原子一定是主族元素
B.离子化合物中任何情况下都不存在分子
C.质量数表示原子相对原子质量的近似值
D.核外电子排布相同的微粒,一定具有相同的化学性质
4.已知自然界氧的同位素有16O、17O、18O,氢的同位素有 H、D,从水分子的原子组成来看,自然界的水一共有( )
A.3种 B.6种 C.9种 D.12种
5. 13C—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,KurtW ü thrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是( )
A.13C与15N有相同的中子数 B.13C与C60互为同素异形体
C.15N与14N互为同位素 D.15N的核外电子数与中子数相同
6.共价键、金属键、离子键和分子间作用力都是构成物质微粒间的不同相互作用,含有上述中两种相互作用力的晶体是( )
A.SiO2晶体 B.CCl4晶体 C.NaCl晶体 D.晶体硅
7.近来查明,二氧化三碳(C3O2)是金星大气层的一个组成部分,下列关于二氧化三碳的说法错误的是 .. .. ( )
A.二氧化三碳的电子式为 :O::C::C::C::O: B.C3O2、CO、CO2都是碳的氧化物
C.C3O2和CO一样可以燃烧生成CO2 D.C3O2和CO2都是碳酸的酸酐
8.下列排列顺序错误的是( )
A.非金属性 As>S>Cl>F B.金属性 Rb>K>Mg>Al
C.稳定性 AsH3<PH3<H2S<HF D.半径 Na>P>O>F
9.下列过程中,共价键被破坏的是( )
A.碘升华 B.溴蒸气被木炭吸附
C.NaCl溶于水 D.HCl气体溶于水
10.下列物质的电子式书写正确的是( )
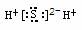 A.NaCl A.NaCl 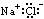 B.H2S B.H2S
C.-CH3 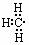 D.NH4I D.NH4I 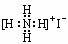
11.第3周期元素R,它的原子核外最外层上达到饱和所需电子数小于次外层和最内层电子数之差,且等于最内层电子数的正整数倍。则关于R的正确说法是( )
A.常温下,能稳定存在的R的高价氧化物都能与烧碱溶液反应
B.R的最高价氧化物对应水化物是强酸
C.R和R的氧化物的熔点和硬度都很高
D.R能形成稳定的气态氢化物
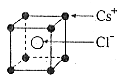 12.已知CsCl晶体的密度为 12.已知CsCl晶体的密度为 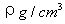 ,NA为阿伏加德罗常数, ,NA为阿伏加德罗常数,
相邻的两个 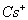 的核间距为a cm,如图所示,则CsCl的相对分 的核间距为a cm,如图所示,则CsCl的相对分
子质量可以表示为
A. 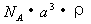 B. B. 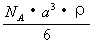
C. 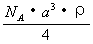 D. D. 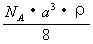
\s 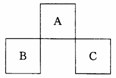 13.A、B、C均为短周期元素,它们在周期表中的位置如左图所示。 13.A、B、C均为短周期元素,它们在周期表中的位置如左图所示。
已知:B、C两元素原子最外层电子数之和等于A元素原子最外层电
子数的2倍;B、C两元素的核电荷数之和是A元素原子序数的4倍。
则A、B、C分别是 ( )
A. C、Al、P B.N、Si、S C.O、P、Cl D.F、S、Ar
14.正电子、反质子等都属于反粒子,它们跟普通电子、质子的质量、电量均相等,而电性相反。科学家设想在宇宙的某些区域可能存在完全由反粒子构成的物质——反物质。1998年初和年底,欧洲和美国的科研机构先后公布:他们分别制造出9个和7个反氢原子,这是人类探索反物质的一大进步。你推测反氢原子是:( )
A.由1个带正电的质子和1个带负电的电子构成
B.由1个带负电的质子和1个带正电的电子构成
C.由1个不带电的中子和1个带负电荷的电子构成
D.由1个带负电荷的质子和1个带负电荷的电子构成
15.20世纪20年代起,就有人预言可能存在由4个氧原子组成的氧分子,但一直没有得到证实。最近,意大利一所大学的科学家使用普通氧分子和带正电的氧离子制造出了这种新型氧分子,并用质谱仪探测到它的存在。你认为这种氧分子是:( )
A.氧元素的一种同位素 B.臭氧的同素异形体
C.一种新的氧化物 D.一种新的化合物
16.甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( )
A.x 2 B.x 4 C.x 8 D.x 18
17、据报道,1995年我国科研人员在兰州首次合成了镤元素的一种同位素镤239,并测知其原子内有148个中子。现有A元素的一种同位素,比镤239的原子核内少54个质子和100个中子,则A元素在周期表中的位置是 ( )
A.第3周期第ⅠA族 B.第4周期第ⅠA族
C.第5周期第ⅠA族 D.第3周期第ⅡA族
18、在短周期元素中,原子最外电子层只有1个或2个电子的元素是( )
A.金属元素 B.稀有气体元素
C.非金属元素 D.无法确定为哪一类元素
19、HgCl2的稀溶液可用作手术刀的消毒液,已知HgCl2的熔点是277℃,熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力,则下列关于HgCl2的叙述不正确的是( )
A.HgCl2是电解质 B.HgCl2是盐,属于离子化合物
C.HgCl2固体是分子晶体 D.HgCl2是盐,属于共价化合物
20、KO2的晶体结构和NaCl相似,KO2可以看作是Na 的位置用K 代替,Cl—的位置用O2—代替,则关于KO2晶体结构的描述正确的是( )
A.和K 距离相同且最近的O2—共有8个
B.和K 距离相同且最近的O2—构成的多面体是正六面体
C.和K 距离相同且最近的K 有8个
D.右图一个超氧化钾小晶粒中含有4个KO2
二、选择题(每小题有一至二个正确答案,每小题4分,共40分)
21、运用元素周期律分析下面的推断,其中错误的是
A、已知Ra是第七周期、ⅡA族的元素,故Ra(OH)2的碱性比Mg(OH)2的碱性强
B、已知As是第四面期、ⅤA族的元素,故AsH3的稳定性比NH3的稳定性强
C、已知Cl的核电荷数比Al的核电荷数大,故Cl的原子半径比Al的原子半径小
D、已知Cs的原子半径比Na的原子半径大,故Cs与水反应比Na与水反应更剧烈
22、下列递变规律正确的是
A、HF、HCl、H2S、PH3的稳定性依次增强
B、Na 、Mg 、Al 、Si 的还原性逐渐增强
C、O、S、Na、K的原子半径依次增大
D、KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强
23、第ⅢA族元素Al、Ga均为两性元素,Al(OH)3与Ga(OH)3相比,后者酸性比前者强。当CO2通入NaAlO2和NaGaO2的溶液中,首先沉淀出来的氢氧化物是
A 、Al(OH)3 B、Ga(OH)3 C、同时沉淀 D 、无法判定
24、X、Y两元素原子的L层电子数都等于它们其他层的电子数之和,下列推断正确的是
A、X与Y可能处于同一周期 B、X与Y可能处于同一主族
C、X与Y形成的单质不是分子晶体就是原子晶体
D、若X的原子序数大于Y的原子序数,则X可能形成不同价态的氧化物
25、X和Y均为短周期元素,已知aXn-比bYm 多两个电子层,则下列说法正确的是
A、b<5 B、X只能位于第三周期
C、a n-b m=10或16 D、Y不可能位于第二周期
26、A、B、C是短周期中的三种元素,原子序数依次递增,A与C为同族元素,C与A可形成原子个数比为1:2或1:3的化合物,B与A只能形成一种化合物,则下列说法正确的是
A、原子半径:A>B>C B、B与A形成的化合物熔点较高
C、B只能是金属 D、B可能是金属,也可能是非金属
27、已知下列反应:Cu X2=CuX2 2Cu Y=Cu2Y 2KX Z2=2KZ X2
且X2、Y、Z2为三种元素的单质,在Cu2Y中Y为-2价。下列关于X、Y、Z三种元素的说法中正确的是
A、X、Y、Z的最高价氧化物的水化物的酸性依次减弱
B、Z、X、Y的单质的氧化性依次增强
C、Y、X、Z形成的简单离子的还原性依次增强
D、Y、X、Z的气态氢化物的稳定性依次增强
28、X、Y、Z三种元素,已知X 和Y-两种离子具有相同的电子层结构,Z元素原子核内质子数比Y元素原子核内质子数少9个,Y-被氧化可生成YZ3-离子。则下列说法正确的是
A、离子半径X >Y- B、X、Y、Z均属于短周期元素
C、X、Y、Z三种元素组成的物质至少有三种 D、Y属于第ⅤA族元素
29.关于VIA族和VIIA族元素的下列说法中正确的是 ( )
A.在同一周期,VIA族元素氢化物的稳定性比VIIA族的强
B.浓度都是0.01mol·L-1时,硫酸溶液的PH值比氯酸溶液的小
C.VIIA族单质的氧化性均比VIA族单质的氧化性强
D.加热时,硫酸钠比氯酸钠易分解
30.在一定条件下RO3-与R-发生如下反应:RO3- 5R- 6H =3R2 3H2O,下列关于R元素及单质的叙述,正确的是( )
A.R原子的最外层有7个电子
B.R位于VA族
C. RO3-中的R只能被还原
D. R2在反应中是还原产物,H2O是氧化产物
三、填空题
31.(10分)按要求回答下列问题
(1)CsCl晶体中每个Cs 四周有 个Cl-,每个Cs 四周与它最近且距离相等的Cs 共有 个。
(2)白磷分子中的键角为 ,分子的空间结构为 ,若将1分子白磷中的所有P-P键打开并各插入一个氧原子,共可结合 个氧原子, 若每个P原子上的孤对电子再与氧原子配位,就可以得到磷的另一种氧化物 (填分子式)。
(3)二氧化硅是一种 晶体,每个硅原子四周有 个氧原子。
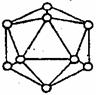 (4) 晶体硼的基本结构单元都是由硼原子组成的正二十面体 (4) 晶体硼的基本结构单元都是由硼原子组成的正二十面体
的原子晶体。其中含有20个等边三角形和一定数目的顶角,
每个顶角各有一个原子,试观察图形回答。这个基本结构单
元由_____个硼原子组成,共含有________个B-B键。
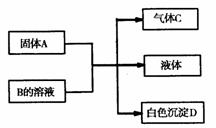 32. (共7分)A、B、C、D均为中学化学的常见物质,它们间的反应关系如图所示: 32. (共7分)A、B、C、D均为中学化学的常见物质,它们间的反应关系如图所示:
(1)若A是短周期主族元素中原子半径最大的元素构成的单质,D既可溶于盐酸又可溶于NaOH溶液。图示转化中的离子方程式为 。
(2)若C是元素M的气态氢化物,且C能与M的最高价氧化物的水化物反应生成盐E;B是一种正盐,与E含有相同的阳离子;D不溶于稀硝酸。
A的化学式为 。
C的电子式为 ,C的空间构型是 。
B的溶液中各离子浓度由大到小的顺序为 。
33.(14分)已知X、Y、Z、W是元素周期表中短周期中的四种非金属元素,它们的原子数依次增大,X元素的原子形成的阳离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。试回答:
(1)写出下列元素的元素符号
X 、Y 、Z 、W 。
(2)X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为(请注明反应条件) 。E分子的空间构型为 ,电子式为 。E在催化剂存在的条件下可用于还原汽车尾气中的 ,以减少对大气的污染。
(3)仅由X、Z、W三种元素组成的某种盐是一种速效肥料,但长期施用会使土壤酸化,有关的离子反应方程式为 。
(4)这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序),该化合物的水溶液与足量NaOH溶液反应的离子方程式 。
(5)将9g单质Y在足量W单质中燃烧,所得气体通入lL lmol·L-1NaOH溶液中,完全吸收后,溶液中的各离子浓度由大到小的顺序是 。
34.(8分)A~J是中学化学中常见的几种物质,它们之间的转化关系如下图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F化合生成,J可作禽流感、SARS等病毒的杀菌消毒剂。
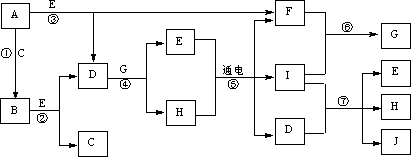
(1)写出E、B的电子式:B_______________。E 。
(2)写出反应⑦的离子方程式:_________________________________。
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式:____________________________________________________________。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则阳极的电极反应式为:__________________。_____________极(填“阴”或“阳”)四周溶液由无色变为红色的原因是 。
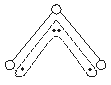
35. (6分)1994年度诺贝尔化学奖授予为研究臭氧做出非凡贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图所示,呈V型,键角为116.5°。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个非凡的化学键(虚线内部分)——三个O原子均等地享有这4个电子。请回答:
 \* MERGEFORMAT \* MERGEFORMAT
(1)臭氧与氧气的关系是 。
(2)写出下列分子与O3分子的结构最相似的是
A.H2O B.CO2 C.SO2 D.BeCl2
(3)分子中某原子有1对没有跟其他原子共用的价电子叫孤对电子,那么O3分子
有 对孤对电子。
(4)O3分子是否为极性分子 (是或否)。
(5)O3与O2间的转化是否为氧化还原反应(若否,请回答A小题;若是,请回答B小题)。
A.O3具有强氧化性,它能氧化PbS为PbSO4而O2不能,试配平:
PbS+ O3—— PbSO4+ O2
B.O3在催化剂作用下生成1 mol O2转移电子数 mol
36. (5分)下图是超导化合物----钙钛矿晶体中最小重复单元(晶胞)的结构。请回答:
(1)该化合物的化学式为 。
(2)在该化合物晶体中,与某个钛离子距离最近且相等的其他钛离子共有 个。
(3)设该化合物的式量为M,密度为ag/cm3,阿伏加德罗常数为NA,则晶体中钙离子与钛离子之间的最短距离为 。
班别 姓名 座号 成绩
31.(10分)(1) -, 。
(2) , , , 。
(3) , 。(4)_____, ________
32. (共7分)(1)
(2) , 。
, 。
33.(14分)(1)X 、Y 、Z 、W 。
(2) 。
, 。 。
(3) 。(4) 。
(5) 。
34.(8分)(1)_______________。 。
(2)_________________________________。
(3)____________________________________________________________。
(4)__________________。_____________、
。
35. (6分)(1) 。(2)
(3) (4)
(5) PbS+ O3—— PbSO4+ O2
36. (5分)(1) 。(2) (3 ) 。
|
1 |
B |
2 |
C |
3 |
C |
4 |
C |
5 |
C |
6 |
B |
7 |
B |
8 |
A | |
9 |
D |
10 |
C |
11 |
A |
12 |
C |
13 |
C |
14 |
B |
15 |
B |
| |