|
高三化学上学期第四次月考试题
试 题
考试时间:90分钟 满分100分 命题人:杨素娟 2008.1.2
相对原子质量:H-1 O-16 N-14 Na-23 C1-35.5 Fe-56
第I卷
本卷共16小题,每小题3分,共48分,每小题只有一个选项符合题目要求。
1、由解放军总装备部军事医学研究所研制的小分子团水,解决了医务人员工作时间的如厕难题。新型小分子团水,具有饮用量少,渗透力强,生物利用度高,在人体内储留时间长,排放量少的特点。一次饮用125mL小分子团水,可维持人体6小时正常需水量。下列关于小分子团水的说法正确的是( )
A、水分子的化学性质改变
B、水分子内氢、氧原子核间的距离(键长)缩短
C、水分子间作用力减弱
D、水分子间结构、物理性质改变
2、据报道,近日某地一辆满载砒霜的大货车翻下山坡,滑下河道,部分砒霜散落到河水中。砒霜的主要成分是As2O3,剧毒,致死量为0.1g,可用于制造杀虫剂和灭鼠剂等。As2O3是两性偏酸性氧化物,其无色晶体在193℃升华,微溶于水,生成H3AsO3;其对应的盐也均有毒性,其中碱金属对应的盐溶于水,其他金属对应的盐几乎不溶于水。根据以上信息判定下列说法正确的是( )
A、As2O3的晶体为原子晶体 B、As2O3是砷酸的酸酐
C、可向该河中撒入生石灰,以消除砷对河水的污染
D、可向该河中撒入氢氧化钠,以消除砷对河水的污染
3、砹(At)是1869年门捷列夫指出的类碘,它的发现经历了曲折的道路,直到1940年才由美国科学家用а粒子轰击铋获得,下列推测砹或砹的化合物最不可能具有的性质是( )
A、HAt很稳定 B、砹易溶于某些有机溶剂
C、AgAt不溶于水 D、砹是有色固体
4、下列微粒中能影响水的电离平衡且能使水的电离平衡向右移动的是( )

‥
A、CH3COOH B、[﹕O﹕H ]- C、HSO4- D、bX2-
‥
5、H+浓度相同的等体积的两份溶液A和B,A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的质量相同,则下列说法正确的是( )
①反应所需要的时间B>A ②开始反应时的速率A>B ③参加反应的锌的物质的量A=B ④反应过程的平均速率B>A ⑤盐酸里有锌剩余⑥醋酸里有锌剩余
A、③④⑥ B、②③⑥ C、③④⑤ D、①②⑤
6、下列实验中颜色的变化与有关物质的强氧化性无关的是( )
A、乙炔使酸性高锰酸钾溶液褪色 B、过氧化钠使品红溶液褪色
C、SO2使滴有酚酞的红色NaOH溶液褪色 D、氯气使鲜花褪色
7、要求设计实验验证:某种盐的水解是吸热的。有四位同学分别设计如下方案,其中不正确的是( )
A、甲同学:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
B、乙同学:用加热的方法除去KNO3溶液中混有的Fe3 ,说明含Fe3 的盐水解是吸热的
C、丙同学:通过实验发现同浓度的热的纯碱溶液比冷的纯碱溶液去油污效果好,说明碳酸钠水解是吸热的
D、丁同学:在醋酸钠溶液中滴入酚酞试夜,加热(不考虑水蒸发)后若红色加深,说明醋酸钠水解是吸热的
8、在下图的实验装置中,实验开始一段时间后,对看到的现象叙述不正确的是( )
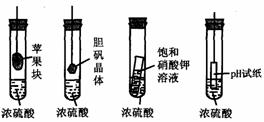
A、苹果块会干瘪 B、胆矾晶体表面有“白斑”
C、小试管内有晶体析出 D、pH试纸变红
9、高温下硫酸亚铁发生如下反应:2FeSO4====Fe2O3 SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是( )
A、BaSO3和BaSO4 B、BaS C、BaSO3 D、BaSO4
10、草酸是二元弱酸,草酸氢钾溶液呈酸性,在0.1mol·L-1KHC2O4溶液中,下列叙述正确的是( )
A、c(K ) c(H )=c(HC2O4-)+c(OH-) c(C2O42-)
B、c(HC2O4-) c(C2O42-)=0.1mol·L-1
C、c(C2O42-)<c(H2C2O4)
D、c(K )=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
\* MERGEFORMAT 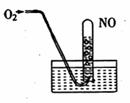 11、如图所示,当向试管内通入21mLO2时,最后试管中 11、如图所示,当向试管内通入21mLO2时,最后试管中
的液面仍在原来的位置,则原试管中NO为( )
A、6mL B、12mL
C、16mL D、18mL
12、用NA表示阿伏加德罗常数的数值,下列说法中正确的是( )
A、将标准状况下的22.4LCl2通入水中充分反应后转移的电子数为NA
B、0.1molHClO分子中所含共价键数为0.2NA
C、常温、常压下,5.8gNa35Cl所含分子数为0.1NA
D、标准状况下,36.5g沸点最低的卤素氢化物所含质子数为10NA
13、下列离子方程式不正确的是( )
A、Fe(OH)3与氢溴酸溶液反应:Fe(OH)3 3H ====Fe3 3H2O
B、实验室制取Cl2:MnO2 4H 2Cl-====Mn2 Cl2↑ 2H2O
C、次氯酸钙溶液中通入过量的CO2:ClO- CO2+H2O====HClO+HCO3-
D、FeBr2溶液中滴入过量氯水:2Fe2++6Br- 4Cl2====2Fe3 +3Br2 8Cl-
14、25℃时,某溶液中由水电离产生的c(H )和c(OH-)的乘积为1×10-20,下列说法正确的是( )
A、该溶液的pH一定是10 B、该溶液可能pH=4
C、该溶液的pH可能是7 D、由于溶液中盐的水解造成的
15、为了除去SO2气体中含有的少量HCl,最好将气体通过( )
A、浓H2SO4 B、Na2SO3饱和溶液 C、NaHSO3饱和溶液 D、固体NaOH
16、amol FeS与bmol FeO投入到VL、cmol·L-1的硝酸溶液中恰好完全反应,还原产物只有NO,所得澄清溶液成分可看做是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
①(a b)×63g ②(a b)×189g ③(a b)mol ④(Vc- 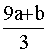 \* MERGEFORMAT )mol \* MERGEFORMAT )mol
A、①④ B、②③ C、①③ D、②④
第II卷
\* MERGEFORMAT  本卷共6题,共52分 本卷共6题,共52分
17、(6分)某学生课外活动小组利用如图所示装置分别做如下实验:
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是 溶液;加热时溶液由红色逐渐变浅的原因是 。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,此溶液可能是 溶液;加热时溶液由无色变为红色的原因是 。
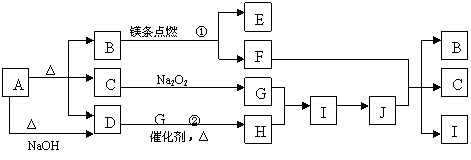
18、(8分)如下图A~J分别代表相关反应中的一种物质,已知A分解后得到等物质的量的B、C、D,图中有部分生成物未标出。请填写以下空白:
(1)B的电子式为 ,D分子的空间构型为 。
(2)写出反应①、②的化学方程式:① ,
② 。
(3)写出反应③的离子方程式: 。
19、(11分)认真阅读下列信息,回答提出的问题。
a.PCl3在热水中水解,产物之一为亚磷酸(H3PO3),其结构式为:
b.H3PO3与NaOH反应,只生成Na2HPO3和NaH2PO3两种盐;
c.H3PO3与碘水反应,碘水的棕黄色褪去,再加入过量的AgNO3溶液,生成黄色沉淀M,过滤后再向滤液中加入适量CaCO3粉末,又生成黄色沉淀N;
d.盛H3PO3的试管中加入AgNO3溶液,有黑色Ag生成,试管口处有红棕色气体生成。
回答下列问题:
(1)H3PO3是 元 酸(填“强”或“弱”),具有 性(填“氧化”或“还原”)。
(2)信息c中的黄色沉淀M是 ,N是 。(填化学式)
(3)H3PO3与AgNO3溶液反应的化学方程式是 ,其中被还原的元素是 ;
(4)PCl5遇热水也像PCl3一样水解,其反应的化学方程式是 ;
(5) H3PO2是一种弱酸,它与过量的NaOH溶液反应后的产物为NaH2PO2。则H3PO2是一种 元弱酸,NaH2PO2溶液呈 性,原因是(用离子方程式表示) 。
20、(6分)(1)已知在一定条件下可以发生下列反应:
H2O2+2Fe2 2H ====2Fe3 +2H2O
H2O2+2Fe3 ====2Fe2 O 2↑+2H+
在以上反应中Fe2 实际上起着 作用,总反应式为 。
(2)I2也与Fe2 一样能发生上述类似反应,类比(1)在下面填入配平的合适的化学反应方程式:H2O2+I2====2HIO
总反应式为
(3)在H2SO4和KI的混合溶液中加入足量的H2O2,放出大量的无色气体,溶液呈棕色,并可以使淀粉变蓝,有学生认为该反应的离子方程式为:
H2O2 2I-==== I2+O2↑+2H+,这个方程式正确吗? 。
若正确,理由是(若认为不正确,该步不必作答) 。
若不正确,理由是(若认为正确,该步不必作答) 。
 21、(9分)下图装置中,当浓盐酸和重铬酸钾共热产生有色气态单质X,X经A、B两瓶后在C处与热的白色晶体反应,最后在D瓶有紫黑色晶状物。回答下列问题: 21、(9分)下图装置中,当浓盐酸和重铬酸钾共热产生有色气态单质X,X经A、B两瓶后在C处与热的白色晶体反应,最后在D瓶有紫黑色晶状物。回答下列问题:
(1)制取X气体时,需要用到的玻璃仪器有 。
(2)若K2Cr2O7被还原成Cr3 ,写出制取X的化学方程式 。
(3)要得到纯净的X气体,A瓶应盛放 ,B瓶应盛放 。
(4)C处的白色晶体是 。D瓶的紫黑色晶体是 。
C处加热的目的是 。
(5)E装置盛 ,作用是 。
22、(12分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表: |
实验编号 |
HA物质的量浓度(mol/L) |
NaOH物质的量浓度(mol/L) |
混合溶液的pH | |
甲 |
0.2 |
0.2 |
pH=a | |
乙 |
c1 |
0.2 |
pH=7 | |
丙 |
0.2 |
0.1 |
pH>7 | |
丁 |
0.1 |
0.1 |
pH=9 | | ![]() 三角锥形
三角锥形 ![]() 2MgO C ② 4NH3 5O2
2MgO C ② 4NH3 5O2 ![]() 4NO 6H2O
4NO 6H2O