| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
(假设:①盐类共存时不影响各自的溶解度;②分离晶体时,溶剂的损耗忽略不计) 某同学设计用物质的量比为1∶1的NaNO3和KCl为原料,加入一定量的水制取KNO3的实验,其流程如下框图所示。
(1)在①和③的实验过程中,要害的实验条件是_________。 (2)分离出晶体的②和④两操作是_______(填倾倒、蒸发、结晶、过滤中的某种操作)。KNO3是晶体_______(A或C)。 (3)粗产品中可能含有的杂质离子是______,检验的方法是_____________________。 (4)将该粗产品提纯,可采取的方法是__________________。 25、(12分)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键
| Si—O
| Si—Cl
| H—H
| H—Cl
| Si—Si
| Si—C
| 键能/kJ·mol—1
| 460
| 360
| 436
| 431
| 176
| 347 |
请回答下列问题:
|
● |
 (1)比较下列两组物质的熔点高低(填“>”或“<”
(1)比较下列两组物质的熔点高低(填“>”或“<”
SiC Si; SiCl4 SiO2
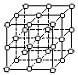
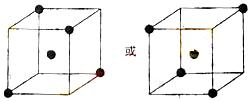
(2)右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3)工业上高纯硅可通过下列反应制取:
SiCl4(g) 2H2(g) 高温 Si(s) 4 HCl(g)
该反应的反应热△H = kJ/mol.
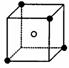
 = 4 \* GB2 ⑷右图中直线交点处的圆圈为NaCl晶体中Na 离子和Cl—离子所处的位置。请将其中代表Na 离子的圆圈涂黑(不考虑体积大小),以完成NaCl晶体的结构示意图。晶体中,在每个Na 离子四周与它最接近的且距离相等的Na 离子共有 个。
= 4 \* GB2 ⑷右图中直线交点处的圆圈为NaCl晶体中Na 离子和Cl—离子所处的位置。请将其中代表Na 离子的圆圈涂黑(不考虑体积大小),以完成NaCl晶体的结构示意图。晶体中,在每个Na 离子四周与它最接近的且距离相等的Na 离子共有 个。
26.(10分)下表列出了前20号元素中的某些元素性质的有关数据:
元素编号
元素性质
= 1 \* GB3 ①
= 2 \* GB3 ②
= 3 \* GB3 ③
= 4 \* GB3 ④
= 5 \* GB3 ⑤
= 6 \* GB3 ⑥
= 7 \* GB3 ⑦
= 8 \* GB3 ⑧
= 9 \* GB3 ⑨
= 10 \* GB3 ⑩
原子半径(10-10m)
1.52
2.27
0.74
1.43
0.77
1.10
0.99
1.86
0.75
0.71
最高价态
1
+1
-
+3
+4
+5
+7
+1
+5
-
最低价态
-
-
-2
-
-4
-3
-1
-
-3
-1
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是 (填写编号)。
 (2)上述 = 5 \* GB3 ⑤、 = 6 \* GB3 ⑥、 = 7 \* GB3 ⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式) 。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于 ;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式 。
(2)上述 = 5 \* GB3 ⑤、 = 6 \* GB3 ⑥、 = 7 \* GB3 ⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式) 。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于 ;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式 。
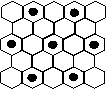
(3)元素 = 5 \* GB3 ⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的 = 2 \* GB3 ②单质相互作用,形成某种青铜色的物质(其中的元素 = 2 \* GB3 ②用“●”表示),原子分布如图所示,该物质的化学式为 。
27.(11分) A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。
根据以上信息,回答下列问题:
(1)A和D氢化物中,沸点较低的是________(选填“A”或“D”);A和B的离子中,半径较小的是________________(填离子符号)。
(2)元素C在元素周期表中的位置是________。
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)均位于小正方体中心。该化合物的电子式是________。
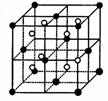
晶胞 晶胞的 ![]()
= 4 \* GB2 ⑷分别写出A、B的电子排列式,C的轨道表示式:
A.________ B._________C._______
28.(11分)下面是关于药物华素片(西地碘片)使用说明书的部分内容。
|
华素片(西地碘片)使用说明书 [品名和组成] 品名:西地碘片 商品名:华素片 英文名:Cydiodine Tablets 华素片(西地碘片)的主要活性成分是分子碘,含量1.5mg/片。将碘利用分子分散技术制成分子态西地碘,并含适量薄荷脑等。 [贮藏]遮光、密闭、在阴凉处保存。 [有效期]二年 |
![文本框: 华素片(西地碘片)使用说明书
[品名和组成]
品名:西地碘片
商品名:华素片
英文名:Cydiodine Tablets
华素片(西地碘片)的主要活性成分是分子碘,含量1.5mg/片。将碘利用分子分散技术制成分子态西地碘,并含适量薄荷脑等。
[贮藏]遮光、密闭、在阴凉处保存。
[有效期]二年](/Education/UploadFiles_6227/200912/20091208220652652.gif)
(1)根据上述说明和所学化学知识回答:
①华素片中含有的活性成分是 (写分子式)
②请推断华素片 (“是”或“不是”)白色。
(2)某学生为验证华素片中确实含有上述成分,完成实验如下,请填空:
①取一粒药片放入研钵中研碎,再将药粉装入试管并加入约2mL蒸馏水;向该试管中再加入约2mL (填选项字母),并用力振荡;
A.酒精 B.热裂汽油 C.四氯化碳 D.甘油
②描述加入该液体后可能观察到的现象
③选用该液体做实验的原因是
(3)请再设计另一种方法,验证华素片中的成分,(注重叙述实验原理、操作方法和实验结论)
(4)华素片中主要成分在室温时属 晶体。
21、湿润_检漏、润洗_干燥
22、(1)将导管的出口浸入水槽的水中,手握住试管,有气泡从导管口逸出,放开手后,有少量水进入导管,表明装置不漏气。
(2)②①③ (3)慢慢将量筒下移
(4)[22.4L.mol-1 ×298K× (a-b)g]/ 273K × c L
|
△ |
|
==== |
(1)逐渐变深 Fe(OH)3胶粒带正电荷 电泳
(2)形成红褐色沉淀 电解质(NH4)2SO4电离出的SO ![]() 离子中和了胶体粒子所带电荷,使Fe(OH)3胶体聚沉
离子中和了胶体粒子所带电荷,使Fe(OH)3胶体聚沉
(3)先出现红褐色沉淀,后沉淀溶解形成黄色溶液 电解质H2SO4使Fe(OH)3胶体聚沉,随着H2SO4的加入,H 与Fe(OH)3发生反应Fe(OH)3 3H =====Fe3 3H2O,使沉淀溶解。
(4)渗析
24、解析:(1)等物质的量的NaNO3和KCl溶于水后,所形成的四种物质皆易溶于水,要分离它们只能根据不同温度下溶解度的不同进行,因此实验①③的要害条件是温度。
(2)分离KNO3(NaCl)晶体与溶液的操作为过滤。根据题目所给溶解度数据,100℃时蒸发H2O后得到NaCl晶体(NaCl溶解度最小),冷却后得到的主要是KNO3(溶解度之差最大),故C是KNO3。
(3)在100℃时NaCl溶液已饱和,故降温冷却过程中,在得KNO3晶体的同时,有少量NaCl析出,即晶体中含Na 、Cl-,Na 用焰色反应检验,Cl-用AgNO3溶液和稀HNO3检验。
(4)对含有少量NaCl的KNO3可用重结晶的方法提纯。
 答案:(1)温度 (2)过滤 C (3)Na 、Cl- Na 用焰色反应检验,Cl-用AgNO3溶液和稀HNO3检验 (4)重结晶
答案:(1)温度 (2)过滤 C (3)Na 、Cl- Na 用焰色反应检验,Cl-用AgNO3溶液和稀HNO3检验 (4)重结晶
25、⑴ > < ⑵ 如下图 ⑶ 236(12个)
26、(⑴② ⑵PCl3或CCl4 第三周期、ⅥA族 ![]() ⑶KC8)
⑶KC8)
27、(1)D ![]() (2)第三周期、 = 3 \* ROMAN III族
(2)第三周期、 = 3 \* ROMAN III族
(3) ![]() (每空2分,共8分)
(每空2分,共8分)
28.(1)① I2 ②不是;(2)①C ②溶液分层、上层无色下层紫色;③CCl4与水互不相溶且I2在CCl4中溶解度比在水中的大 (3)取一粒华素片研细后溶于水配成溶液再滴加淀粉溶液如溶液变蓝则说明其含I2。
| |