| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
10.NA代表阿伏加德罗常数值,下列说法正确的是 A.32gCu与足量的硫蒸汽充分反应,电子转移总数为1.0 NA B.1.4 g乙烯和丙烯的混合物中含碳原子数为0.l NA C.6.4gCaC2晶体中含有0.2 NA个阴离子 D.2.24L(标准状况)Cl2与足量NaOH溶液在常温下反应.转移的电子数为0.2 NA 11.下列现象或应用中,不涉及胶体性质的是 A. 在饱和的氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀 B. 清晨,在茂密的树林中,经常可以看到从枝叶间透过的道道光柱 C.用半透膜分离淀粉和食盐的混合液 D.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
A.分子中至少有8个碳原子处于同一平面上 B.分子中至少有9个碳原子处于同一平面上 C.该烃的一氯取代物最多有四种 D.该烃是苯的同系物 13.下列几种情况下,前一量的数值是后一量的数值的二倍的是 A.0.1mol/L K2S溶液中c(K )与c(S2-) B.乙烯分子中C=C键能与乙烷分子中C-C键能 C.MnO2与浓盐酸加热反应时,被氧化的盐酸的物质的量与参加反应的MnO2的物质的量 D.Cu(g)→Cu2 (g)所需能量与Cu (g)→Cu (g)所需能量
A.在A点:c(Na+)﹥c(OH-)﹥c(CH3COO-)﹥c(H+) B.在B点:c(OH-)﹦c(H+),c(Na+)﹦c(CH3COO-) C.在C点:c(CH3COO-)﹥c(Na+)﹥c(H+) ﹥c(OH-) D.在C点:c(CH3COO-)+c(CH3COOH)﹦2 c(Na+)
A.a电极上发生的电极反应式为:O2+4H++4e-=2H2O B.b电极上发生的电极反应为还原反应 C.外电路中电子从b电极流向a电极 D.电池工作时电池内部的电解质溶液pH不变 16.恒温下,容积均为2L的密闭容器M、N中,分别有以下列两种起始投料建立的可逆反应 3A(g) 2B(g) A.x=2 B.平衡时M中c(A)=0.6mol/L C.y﹥0.8 D.y=2 08届高三第三次月考化学答题卡 第Ⅰ 卷(选择题,共48分) 一、选择题(每题只有一个选项符合要求, 每小题3分,共48分)
| 题号
| 1
| 2
| 3
| 4
| 5
| 6
| 7
| 8
| 答案
|
|
|
|
|
|
|
|
| 题号
| 9
| 10
| 11
| 12
| 13
| 14
| 15
| 16
| 答案
|
|
|
|
|
|
|
| |
第Ⅱ卷(非选择题,共52分)
二、实验题(本题包括1小题,共12分)
 17.(12分)已知KMnO4、MnO2在酸性条件下均能将草酸钠(Na2C2O4)氧化:
17.(12分)已知KMnO4、MnO2在酸性条件下均能将草酸钠(Na2C2O4)氧化:
MnO4-+C2O42-+H+→Mn2++CO2↑+H2O(未配平)
MnO2+C2O42-+4H+=Mn2++2CO2↑+2H2O
某研究小组为测定某软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样
品,加入2.68g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),
充分反应之后冷却、滤去杂质,将所得溶液转移到容量瓶中并定容;从中取
出25.00mL待测液置于锥形瓶中,再用0.0200mol·L-1KMnO4标准溶液进行滴定,当滴入20.00mLKMnO4溶液时恰好完全反应。
试回答下列问题:
⑴配平: MnO4-+ C2O42-+ H+― Mn2++ CO2↑+ H2O
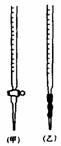
⑵0.0200mol·L-1KMnO4标准溶液应置于 (选填“甲”或“乙”)滴定管中;滴定终点如何判定
。
⑶你能否帮助该研究小组求得软锰矿中MnO2的质量分数 (选填“能”或“否”)。若回答“能”,请给出计算结果;若回答“否”,试说明原因
。
⑷若在实验过程中存在下列操作,其中会使所测MnO2的质量分数偏小的是 。
A.溶液转移至容量瓶中,未将烧杯、玻棒洗涤
B.滴定前尖嘴部分有一气泡,滴定终点时消失
C.定容时,俯视刻度线
D.滴定前仰视读数,滴定后俯视读数
E.锥形瓶水洗之后未用待测液润洗
三、填空题(本题包括3小题,共32分)
18.Ⅰ(4分)下列实验操作中,仪器需插入液面下的有 ( )
① 制备Fe(OH)2,用胶头滴管将NaOH溶液滴入FeSO4溶液中;
② 制备氢气,简易装置中长颈漏斗的下端管口;
③ 分馏石油时,测量温度所用的温度计;
④ 用乙醇制乙烯时所用的温度计;
⑤ 用水吸收氨气时的导气管;
⑥ 向试管中的BaCl2溶液中滴加稀硫酸
Ⅱ(4分)下列有关实验的叙述中,不正确的有 ( )
① 蒸干AlCl3溶液可得纯净的无水氯化铝;
② 硝酸、溴水不可以长期盛放在棕色滴瓶中
③ 无法用分液漏斗将甘油和水的混合液体分离;
④ 用酸式滴定管量取20.00mL高锰酸钾酸性溶液;
⑤ 为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比;
⑥ 苯与溴水在铁粉的催化作用下制备溴苯;
⑦ 滴定时左手控制滴定管,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面
⑧ 在氢氧化铁胶体中加少量硫酸会产生沉淀
⑨ 配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止;
Ⅲ(3分)实验室制取氢氧化铁胶体的方法是
可用 (方法)证实胶体已经制成。
19.(10分)根据下列框图关系填空,已知反应①、③是我国工业生产中的重要反应,X常温下为无色无味透明液体;C焰色反应火焰呈黄色,J为红褐色沉淀;D、E常温下为气体,且E能使品红溶液褪色;A固体中仅含两种元素,其中金属元素的质量分数约为46.7%。
|
+X |
|
+D,高温 |
|
Δ |
|
+X |
|
B固体 |
|
A固体 |
|
C |
|
D |
|
E |
|
F |
|
G |
|
H |
|
I |
|
J |
|
F |
|
① |
|
② |
|
③ |
|
④ |
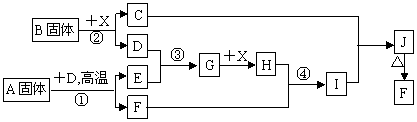 |
(1)G的化学式为 ;
(2)固体A中所包含的化学键与固体B类似,则A的电子式为 ;
(3)反应②的离子方程式: ;
(4)反应④的离子方程式: ;
(5)已知每生成16 g E,放出106.5 kJ热量,则反应①的热化学方程式为:
。
20.(11分)某溶液中含有K 、NH4 、Al3 、OH-、AlO2-、SO42-、CO32-、SiO32-、Cl-等离子中的某几种。现进行如下实验:
①取少量溶液逐滴加入盐酸,先无明显现象,当盐酸加到一定体积后开始产生沉淀并逐渐增多,在沉淀不再增加后又产生一种无色气体,在气体不再产生后沉淀开始溶解,直至最后完全消失;
②取①所得溶液,加入Ba(OH)2溶液,无明显现象。
⑴原溶液中肯定存在的离子是 ;
肯定不存在的离子是 。
⑵已知用一定体积的原溶液进行实验①时,需消耗0.2 mol/L的盐酸5 mL,这时向所得溶液中加入足量的硝酸银溶液可得沉淀0.187g,则原溶液中 (填“有”“没有”或“不确定”)Cl-。
四、计算题(本题包括1小题,共8分)
21.(8分)400K、1.01×105 Pa时,2 L烃A的蒸气能在V L氧气中完全燃烧,反应后体积增至(V+4) L(体积在同前的条件下测定)。请回答:
(1) 烃A在组成上应满足的条件是 。
(2) 当V=15时,该烃可能的分子式为 。
(3) 若A在常温常压下为气态,V的取值范围是 。
08届高三第三次月考化学参考答案
第Ⅰ 卷(选择题,共48分)
一、选择题(每题只有一个选项符合要求, 每小题3分,共48分)
题号
1
2
3
4
5
6
7
8
答案
C
B
B
B
D
C
D
B
题号
9
10
11
12
13
14
15
16
答案
C
B
A
B
C
A
C
D
第Ⅱ卷(非选择题,共52分)
二、实验题(本题包括1小题,共12分)
17.(12分)
⑴2 5 16 2 10 8 (2分)
⑵甲(2分) 当看到加入1滴KMnO4溶液,锥形瓶中溶液立即变成紫红色,且半分钟内不褪色,即达到滴定终点 (2分)
⑶ 否(2分) 因为不知道容量瓶的规格(2分)
⑷ BC(2分)
三、填空题(本题包括3小题,共32分)
18.Ⅰ(4分) ①②④ (错一个扣1分,答对一个给一分,答对两个给两分)
Ⅱ(4分) ①⑤⑥⑦ (错一个扣1分,答对一个给一分)
Ⅲ(3分)向沸腾的水中滴加少量氯化铁饱和溶液(1分)并继续煮沸至液体呈红褐色(1 分) ,丁达尔效应 (1分)
19.(10分)
|
|
|
|
(3)2Na2O2 2H2O=4Na 4OH- O2↑(2分)
(4)Fe2O3 6H =2Fe3 3H2O (2分)
(5)4FeS2(S) 11O2(g)=2Fe2O3(S) 8SO2(g);△H=-3408 kJ·mol-1(2分)
20.(11分)
(1)OH-、AlO2-、CO32-、K ,(4分)
NH4 、Al3 、SO42-、SiO32-,(4分)
(2)有(3分)
四、计算题(本题包括1小题,共8分)
21:(8分)
(1)烃分子中氢原子数为8;(3分)
(2)C3H8、C4H8、C5H8;(3分)
(3)≥12(2分)。
解析:
(1)应用公式计算氢原子数。2(y/4-1)=2,y=8。即烃中氢原子数应为8。
(2)可能出现的烃及耗氧量是:C3H8 5×2=10;C4H8 6×2=12;C5H8 7×2=14;C6H8 8×2=16>15。故可能的分子式为:C3H8、C4H8、C5H8。
(3)A在常温常压下为气态,可能为C3H8、C4H8,二者都要满足,故V 应不小于12。
| |