| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
20.设NA表示阿伏加德罗常数,下列叙述中正确的是( ) A.80g硝酸铵含有氮原子数为2 NA B.常温常压下,22.4L的D2、H2组成的气体分子数为NA C.标准状况下,2.24LSO3中含有的氧原子数为0.3 NA D.1molNa2O2与足量CO2反应转移的电子数NA 21.有机物甲发生银镜反应,甲催化加氢还原成有机物乙,1mol乙跟足量的金属钠反应放出标准状况下氢气22.4L,据此推断乙一定不是( ) A.HOCH2CH2OH B.HOCH2CH(OH)CH3 C.CH3CH2CH2OH D.CH3CH(OH)CH(OH)CH3 22.常温时0.1mol/LHA溶液的pH > 1,0.1mol/LBOH溶液中c(OH-)∶c(H )=1012,将两溶液等体积混合,以下判定正确的是( ) A.c(H )< c(OH-)< c(A-)< c(B ) B.c(OH-)< c(H )< c(B )< c(A-) C.c(H ) c(B )= c(A-) c(OH-) D.c(A-)= c(B )>c(H )= c(OH-) 第Ⅱ卷(共84分) 四、(本题共24分) 23.(8分)H2O2是一种重要的氧化剂,亦具有还原性。下列①~④个涉及H2O2的反应(未配平、条件略)。 ①Na2O2 HCl→NaCl H2O2 ②H2O2 →H2O O2 ③Ag2O H2O2 →Ag O2 H2O ④H2O2 Cr2(SO4)3 KOH→K2CrO4 K2SO4 H2O。 据此,填写下列空白: (1)配平上述反应④ [ ]H2O2 [ ]Cr2(SO4)3 [ ]KOH→[ ]K2CrO4 [ ]K2SO4 [ ]H2O 当0.1mol氧化剂参加反应时,转移电子 个。 (2)H2O2仅体现还原性的反应是 (填代号),此反应中的氧化产物为 。 (3)H2O2体现弱酸性的反应是 (填代号),其理由为 。 24.(8分)含两种元素的化合物E与NH3反应,生成化合物G和H2,化合物G的相对分子质量约为81,G分子中硼元素和氢元素的质量分数分别是40%和7.4%,由此推断: (1)化合物G的分子式为 ; (2)反应消耗1mol E可生成4molH2,组成化合物E的元素是 和 ;又已知:1molE和2molNH3恰好完全反应,化合物E的分子式是 ; (3)化学上把原子数和电子数均相等的微粒称为等电子体(例如CH4和NH4 为等电子体),化合物G的某种等电子体是一种常见的有机物F,F在常温下为液态,其分子中的原子都在一个平面上,则F的分子式为 ; (4)等电子体具有相似的结构和性质,试写出G分子的结构简式: 。 25.高炉炼铁中发生的基本反应之一如下:FeO(s) CO(g)→Fe(s) CO2(g)-Q(Q>0)。(1)此反应的平衡常数表达式为;K= ; (2)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值 ,平衡常数K值 (填“增大”、 “减小”或“不变”。); (3)已知1100℃时,K= 0.263,此时测得高炉中c(CO2)= 0.025mol/L,c(CO)= 0.1mol/L,在这种情况下,该反应 (填“是”或“没有”)处于化学平衡状态,此时化学反应速率是v正 v逆(填“大于”、“小于”或“等于”),其原因是 。 五、(本题共24分) 26.在实验室中拟用氧化铜、稀硫酸和锌来制取纯净的铜,甲、乙两位同学分别设计了如下实验方案: 甲:①把CuO溶于适量稀硫酸中;②在①的溶液中加入适量Zn,充分反应后过滤、烘干,即得纯净的Cu。 乙:①锌与稀H2SO4反应制H2;②将H2通入CuO中并加热,充分反应后即得纯净的Cu。 回答下列问题: (1)若要制得相同质量的纯Cu,所消耗的锌和稀硫酸的量是:甲 乙(填“大于”、“小于”或“等于”),原因是 。 (2)丙同学认为上述两种方案所制得的Cu都难以保证Cu的纯度,应对上述两种方案加以完善。你 (填“是”或“否”)赞同丙同学的看法。 理由①(对甲同学实验而言) ,②(对乙同学实验而言) 。 (3)请你分别对甲、乙两同学的实验加以完善: ① ; ② 。 27.各地电视台的天气预告中都要预告城市的空气质量。预告中一般将城市空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)分为8个等级。目前,测定空气中SO2含量时主要用一些氧化还原反应。 已知:SO2气体与酸性KMnO4溶液反应时,MnO4—被还原为Mn2 ,SO2被氧化为SO42—。 现有药品:0.1mol/L的酸性KMnO4溶液、颗粒吸附剂、品红试纸、pH试纸。 完成下列各题: (1)配制200mL0.1mol/L的酸性KMnO4溶液需用的仪器有 、 、玻璃棒、胶头滴管、烧杯等,玻璃棒的作用是引流和 。 (2)在测定SO2和可吸入颗粒时,首先应测定 ,原因是 。 (3)写出SO2与酸性KMnO4溶液反应的离子方程式: ; 若气体的流速为a cm3/min,当t min时,200mL0.1mol/L的酸性溶液恰好褪色,则空气中SO2的含量为 (g/cm3)。 (4)若要测定空气中可吸入颗粒的含量,需要测出的数据有 。 六、(本题共20分)
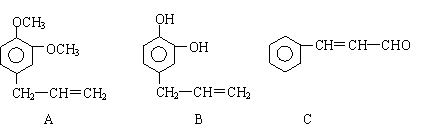 28.从某些植物树叶提取的挥发油中含有下列主要成分: 28.从某些植物树叶提取的挥发油中含有下列主要成分:
(1)写出A的分子式 。 (2)1molB与溴水充分反应,需消耗 mol单质溴。 (3)写出C在一定条件下与足量H2反应的化学方程式:
(4)已知: 写出C在强氧化剂条件下生成的有机化合物的结构简式 。 (5)写出A与B在一定条件下相互反应,生成高分子化合物的化学方程式: 。

 29.CO不仅是家用煤气的主要成分,也是重要的化工原料。美国近年来报导了一种低温低压催化工艺,把某些简单的有机物经“羰化”反应后可以最后产生一类具有优良性能的装饰性高分子涂料、粘合剂等。如下图所示: 29.CO不仅是家用煤气的主要成分,也是重要的化工原料。美国近年来报导了一种低温低压催化工艺,把某些简单的有机物经“羰化”反应后可以最后产生一类具有优良性能的装饰性高分子涂料、粘合剂等。如下图所示:
图中G(RCOOR,)的一种同分异构体是E的相邻同系物;而H的一种同分异构体则是F的相邻同系物。已知D由CO和H2按物质的量之比为1∶2完全反应而成,其氧化产物可发生银镜反应;H是含有4个碳原子的化合物。试写出: (1)结构简式:E 、G 、R,基 。 (2)G的两个同类别同分异构体的结构简式(不带R字母) 及 。 (3)反应类型:X 、Y 、Z 。
① A CO H2O E; ②F D H ① ; ② 。 七、(本题共16分) 30.6.4 g Cu与过量硝酸(a mol / L,30mL)充分反应。硝酸的还原产物只有NO2、NO。反应后溶液中含H 为0.1mol。 (1)此时溶液中所含NO3-为 mol。 (2)求生成的气体中NO2和NO的物质的量各为多少(用含有a的式子表示)? 31.为了测定K2CO3和NaHCO3混合物的组成,某学生每次称取一定质量的混合物溶于水配成溶液,向其中加入相同浓度的Ba(OH)2溶液,每次实验均充分反应,实验结果记录如下表:
| 实验次数
| 混合物的质量/g
| 所加Ba(OH)2溶液的体积/L
| 测得沉淀的质量/g
| 1
| 0.858
| 0.5
| 1.379
| 2
| 1.716
| 0.5
|
| 3
| 2.574
| 0.5
| 4.137
| 4
| 3.432
| 0.5
| 5.516
| 5
| 4.290
| 0.5
| 5.516
| 6
| 5.148
| 0.5
| 5.516 |
请回答下列问题:
(1)第二次实验中产生沉淀的质量是 g;
(2)求所用Ba(OH)2的溶液的物质的量浓度;
(3)求混合物中K2CO3和NaHCO3的物质的量之比;
(4)在25℃时,取下第3组实验所得溶液体积的 ![]() ,加水配成500mL溶液,求此溶液pH(要求写出计算过程)。
,加水配成500mL溶液,求此溶液pH(要求写出计算过程)。
参考答案
一~三、
1
2
3
4
5
6
7
8
9
10
11
D
C
B
A
D
C
C
A
A
B
B
12
13
14
15
16
17
18
19
20
21
22
B
D
C
C
B
D
AB
C
AD
CD
AC
四、
23.(共8分)
(1)3,1,10,2,3,8; (3分) 1.204×1023个。 (1分)
(2)③, O2。 (各1分 共2分)
(3)①,此反应中H2O2由其盐与强酸盐酸反应制得。 (各1分 共2分)
24.(共8分)
(1)B3N3H6; (2分) (2)B、H; B2H6; (各1分 共3分)
|
N—B |
|
H—B N—H |
|
N=B |
|
H |
|
H |
|
H |
|
H |
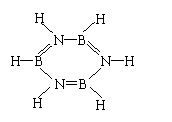 (3)C6H6; (1分)
(3)C6H6; (1分)
(4)
(2分)
25.(共8分)
(1)K= c(CO2)/c(CO); (2分)
(2)增大,增大; (各1分 共2分)
(3)没有;大于;c(CO2)/c(CO)<0.263,因温度不变,K值不变,为增大c(CO2)/c(CO)的值,平衡向正反应方向进行,所以v正>v逆。 (各1、1、2分 共4分)
五、
26.(共12分)
(1)小于;乙方案中氢气的作用除了作还原剂外,还需用来排尽装置中的空气和作保护气。
(各1、2分 共3分)
(2)是;甲方案制得的铜中可能混有锌,且过滤后未洗涤;乙方案制得的铜中可能混有氧化铜。(各1、2、2分 共5分)
(3)①将甲过滤所得的固体加入过量的稀硫酸,不断搅拌,至不再放出气体为止,过滤并洗涤、烘干;②将乙所得的固体加入过量的稀硫酸,不断搅拌,充分反应后过滤并洗涤、烘干。(各2分 共4分)(其他合理解释也给分)
27.(共12分)(1)200mL容量瓶、托盘天平;搅拌。(各1分 共3分)
(2)可吸入颗粒;空气中的固体尘粒轻易被其它溶液吸收。(各1分 共2分)
(3)5SO2 2MnO4— 2H2O→2Mn2 5SO42— 4H ; ![]() (各3、2分 共5分)
(各3、2分 共5分)
(4)吸收前和吸收后固体吸附剂和盛放仪器的质量。(2分)
六、
28.(8分)
(1)C11H14O2 (1分) (2)4 (1分)
(3) ![]()
![]()
![]()
![]() (2分)
(2分)
|
COOH |
|
COOH |
|
COOH |
|
OCH3 |
|
OCH3 |
|
CH2—CH=CH2 |
|
CH2—CH=CH2 |
|
OH |
|
OH |
|
n |
|
n |
|
一定条件下 |
|
n |
|
OH |
|
OH |
|
—CH—CH2— |
|
CH2 |
|
OCH3 |
|
—CH—CH2 |
|
CH2 |
|
H3CO |
|
] |
|
[ |
 (4) (各1分 共2分 )
(4) (各1分 共2分 )
(5)
(2分)
29.(共12分)
(1)E:CH2=CHCOOH;G:CH2=CHCOOCH3;R,基:—CH3。 (各1分 共3分)(2)HCOOCH2CH=CH2;CH3COOCH=CH2。 (各1分 共2分)
|
催化剂 |
|
催化剂 |
②C H3CH2COOH CH3OH CH3CH2COOCH3 H2O
七、
30.(共5分)(1)0.3(2分)
(2)(3分) 设生成气体中NO2、NO的物质的量分别为X mol、Y mol
X=(0.045a-0.55)mol; Y=(0.25-0.015a)mol。
(其他合理解法也给分)
31.(共11分)(1)2.758 (2分)
(2)以第四组数据计算,此时样品混合物过量,
则:Ba(OH)2 ~ Ba2 ~ BaCO3
c[Ba(OH)2]= ![]() mol/L (2分)
mol/L (2分)
(3)以第一组数据计算,设样品混合物中NaHCO3和K2CO3的物质的量分别为x mol和y mol
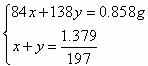
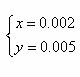
即n(K2CO3)∶n(NaHCO3) = 5∶2 (3分)
(4)设第3次实验中固体混合物中含NaHCO3 x′mol,则含K2CO3 2.5 x′mol
84x′ 138×2.5 x′= 2.574 x′= 0.006 mol
0.5LBa(OH)2溶液中含OH—:0.056×0.5×2 = 0.056 mol
由:HCO3— OH—→CO32— H2O OH—过量:0.056—0.00 6 = 0.05 mol
∴ ![]() (4分)
(4分)
| |