高三化学试卷
题号
一
二
三
四
五
六
七
总分
得分
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共150分,考试时间120分钟.
相对原子质量:H-1;C-12;N-14;O-16;Mg-24;Cl-35.5;Ca—40
第I卷 (共66分)
|
H2O |
|
苯 |
|
① ② ③ ④ |
|
碱石灰 |
|
b |
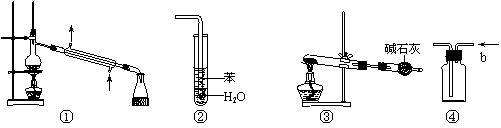 |
A.装置①常用于分离互不相溶液体混合物
B.装置②可用于吸收HCl气体,并防止倒吸
C.以NH4HCO3为原料,装置③可用于实验室制备少量NH3
D.装置④b口进气可收集CO2、NO等气体
14.在一定温度下,可逆反应气A(气) 3B ![]() 2C(气)达到平衡的标志是 ( )
2C(气)达到平衡的标志是 ( )
A.C生成的速度是A反应速度的2倍 B.B、C的浓度不再变化
C.单位时间内生成n摩A,同时生成3n摩B D.A、B、C的分子数之比为1∶3∶2
15.下列实验方法正确的是…………………………………………………………( )
A.用渗析的方法精制氢氧化铁胶体
B.加入适量NaOH溶液后过滤,以除去KCl溶液中少量的MgCl2
C.测定溶液pH,用玻璃棒蘸取原溶液点在润湿的pH试纸上立即与比色卡比较
D.配制一定物质的量浓度氢氧化钠溶液需用到的仪器有天平、容量瓶、玻璃棒、烧杯。
16.类推的思维方式在化学学习与研究中经常采用,但类推出的结论是否正确最终要经过实践的验证。以下类推的结论正确的是 …………………………………( )
A.由“Cl2 H2O → HCl HClO”反应可推出 “F2 H2O → HF HFO” 反应也能发生
B.HCl的水溶液是强酸,推出HF的水溶液也是强酸
C.由“2Fe 3Cl2 → 2FeCl3”反应可推出“2Fe 3I2 → 2FeI3”反应也能发生
D.Na、K在周期表中属于同一主族,化学性质相似,Na常温下与水剧烈反应,故K常温下也能与水剧烈反应
17.已知分子式为C5H12O的醇A共有8种属于醇类的同分异构体,其中能消去水生成烯的醇有 …………………………………………………………………………( )
A.5种 B.6种 C.7种 D.8种
三、选择题(本题共20分),每小题4分,每小题有一个或两个正确选项.只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分.
18.2005年11月,成功登陆“土卫六”的“惠更新”号探测器发回了数百张照片和大量数据。分析指出“土卫六”“酷似地球经常下雨”,不过“雨”的成分是液态甲烷。下列关于“土卫六”的说法中,错误的是…………………………………………………………( )
A.“土卫六”表面温度比地球表面的高 B.“土卫六”上存在有机物
C.“土卫六”表面存在大量液态水 D.“土卫六”上形成了甲烷的气液循环系统
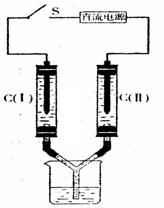 19.如右图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S后,C (Ⅱ)四周溶液变红,
19.如右图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S后,C (Ⅱ)四周溶液变红,
两玻璃管中有气体生成。下列说法正确的是
…………………………………………( )
A.C(Ⅰ)的电极名称是正极
B.C(Ⅱ)的电极反应式是2H 2e → H2↑
C.电子从电源的负极沿导线流向C(Ⅱ)
D.电解过程中,C(Ⅰ)、C(Ⅱ)两极产生的气体
质量相等
20.双氧水属于危险化学品及有毒有害物质,以前也
曾作为漂白剂、杀菌剂、防腐剂广泛用于食品中。
下列有关H2O2的叙述中正确的……………………………………………( )
A.H2O2是二元弱酸,将H2O2溶液滴入含有酚酞的NaOH溶液中,红色消失,一定是因为发生酸碱中和反应
B.H2O2分子中只含有极性键,因此H2O2是极性分子
C.H2O2的自然分解过程非常缓慢,一般不易察觉,但正因为如此,一般药用的双氧水在贮存期间也会逐渐失效
D.人体中含有过氧化氢酶,过氧化氢酶可以使H2O2分解,因此人体即使吸收多量的H2O2也没有关系,可以被过氧化氢酶分解为无毒物质
21.化学与数学有着密切的关系,将某些化学知识用数轴表示,可以收到直观形象、简明易记的效果。下列用数轴表示的化学知识中正确的是………………………( )
A.分散系的分类:
B.常温条件下,酚酞的变色范围:
C.HCl和NaAlO2溶液反应后铝元素的存在形式:
D.CO2通入澄清石灰水中反应的产物:
22.草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.1mol/LKHC2O4溶液中,下列关系正确的是……………………………………………………………………………( )
A.c(K ) c(H )= c(HC2O4-) c(OH-) c(C2O42-)
B.c(HC2O4-) c(C2O42-)= 0.1 mol/L
C.c(C2O42-)> c(H2C2O4)
D.c(K )= c(H2C2O4) c(HC2O4-) c(C2O42-)
第II = 2 \* ROMAN 卷 (共84分)
考生注重:1.答第Ⅱ卷前,考生务必将姓名、学号、班级等填写清楚。
第Ⅱ卷从第23题到第31题,考生应用钢笔或圆珠笔将答案直接写在试卷上。
![]()
四、(本题共24分)
23.(A) A、B、C、D、E、F属于短周期主族元素。其中A元素原子是短周期中原子半径最大的原子,B是最小的原子;C元素原子的最外层电子数为m,次外层电子数为n;D元素原子的L层电子数为m n,M层电子数为m-n;E元素原子的最外层电子数等于其电子层数,且在周期表中与D元素相邻;F元素原子的核外电子数是C元素原子的2倍。A、B、C三种元素可组成化合物X,C、D可组成化合物Y,C、E可组成化合物Z。
(1)写出B的元素符号: A的原子结构示意图 ,
D的电子式 ,F的电子排布式 ;
(2)A→ F六种元素所形成的简单离子中,与Mg2 具有相同电子层结构的是
。(用离子符号表示);
(3)化合物Z与X的水溶液反应的离子方程式为 ;
(4)化合物Y用途广泛,试列举其中一种用途
23.(B)A、B、C、D、E、F属于短周期主族元素。其中A元素原子是地壳中含量最多元素;B的一种单质常做半导体材料;C元素最高价氧化物所对应的水化物能与其对应的气态氢化物反应生成盐;D元素的最外层上具有的电子数等于它具有的电子层数,且原子半径大于B原子;E常温下单质为双原子分子,其水溶液常用于自来水消毒;F元素的原子M层上有2对成对电子。
(1)写出B元素符号 :A的原子结构示意图 ,
D的电子式 ,F的电子排布式 ;
(2)D、E、F三种元素的简单离子中,半径由小到大顺序是 (用相应的元素符号表示)
(3)写出C元素最高价氧化物所对应的水化物能与其对应的气态氢化物反应生成盐的化学方程式 。
(4)试列举含C元素物质的一种用途 。
24.氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
|
高温 |
![]() SiO2 + C+ N2 Si3N4 + CO
SiO2 + C+ N2 Si3N4 + CO
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是 ,其还原产物是 ;
(3)该反应产生标准状况下11.2升CO气体,则电子转移 摩尔。
(4)若有1摩尔焦炭与足量的SiO2、氮气反应,电子转移 (填大于、等于或小于)
2摩尔,理由是 。
25.在一个固定体积为2升的密闭容器中,充入2 mol A和1 mol B,发生如下反应:2A(g) B(g) ![]() 3C(g) D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
3C(g) D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
(1)写出该反应平衡常数的表达式 ,
2分钟内B 的平均反应速度为 。
(2)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为________
(填“吸热”或“放热”)反应。
(3)若将容器体积缩小至1升,反应达到平衡时C的浓度为 mol/L,平衡常数 (填增大、减小或不变)
![]()
五、(本题共24分)
26.(A)在研究硝酸的性质时,某班学生做了如下三个实验:
实验一:试管中加入铜片和浓硝酸,片刻后,立即塞上带有玻璃导管的橡皮塞,导管伸入装有氢氧化钠溶液的烧杯中。
实验二:试管中加入铜片和稀硝酸(可适当加热),片刻后,立即塞上带有玻璃导管的橡皮塞,导管伸入装有氢氧化钠溶液的烧杯中。
实验三:试管中加入红热的木炭和浓硝酸,片刻后,立即塞上带有玻璃导管的橡皮塞,导管伸入装有氢氧化钠溶液的烧杯中。
问:
(1)实验一中发生反应的离子方程式
(2)实验二中硝酸在反应中表现出 性。
(3)实验三现象
(4)若用铜来制取硝酸铜溶液,最好采用下述 方法(填编号),理由
。
A.Cu 4HNO3(浓)→Cu(NO3)2 NO2↑ 2H2O
![]() B.3Cu 8HNO3(稀)→3Cu(NO3)2 2NO↑ 4H2O
B.3Cu 8HNO3(稀)→3Cu(NO3)2 2NO↑ 4H2O
C.2 Cu O2 2CuO, CuO 2HNO3 → Cu(NO3)2 2H2O
(5)把硝酸铜溶液制成硝酸铜晶体,可先将硝酸铜溶液蒸发浓缩、 结晶、 得
到硝酸铜晶体,同时还要注重 (写一条即可)
26.(B)在研究硝酸的性质时,某班学生做了如下三个实验:
实验一:试管中加入铜片和浓硝酸,片刻后,立即塞上带有玻璃导管的橡皮塞,导管伸入装有氢氧化钠溶液的烧杯中。
实验二:试管中加入铜片和稀硝酸(可适当加热),片刻后,立即塞上带有玻璃导管的橡皮塞,导管伸入装有氢氧化钠溶液的烧杯中。
实验三:试管中加入红热的木炭和浓硝酸,片刻后,立即塞上带有玻璃导管的橡皮塞,导管伸入装有氢氧化钠溶液的烧杯中。
问:(1)实验一中硝酸在反应中表现出 性。
(2)实验二现象
(3)实验三中发生反应的化学方程式
(4)若用铜来制取硝酸铜溶液,最好采用下述 方法(填编号),
理由 。
A.Cu 4HNO3(浓)→Cu(NO3)2 NO2↑ 2H2O
![]() B.3Cu 8HNO3(稀)→3Cu(NO3)2 2NO↑ 4H2O
B.3Cu 8HNO3(稀)→3Cu(NO3)2 2NO↑ 4H2O
C.2 Cu O2 2CuO, CuO 2HNO3 → Cu(NO3)2 2H2O
(5)把硝酸铜溶液制成硝酸铜晶体,可先将硝酸铜溶液蒸发浓缩、 结晶、 得
到硝酸铜晶体,同时还要注重 (写一条即可)
27.铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸(主要成分为盐酸)。
|
碾碎后加入试剂1 静置,过滤 |
|
药片 |
|
一段时 间 后 |
|
新制氯水 |
|
试剂2 |
|
淡黄色 溶 液 |
|
淡红色 溶 液 |
|
血红色 溶 液 |
|
溶液褪色 |
 某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
(1)试剂1是 ,试剂2是 ,加入新制氯水所发生的离子反应方程式是 , 。
(2)该同学猜想血红色溶液褪色的原因是溶液中的Fe3+被还原为Fe2+,你认为该同学的猜想合理吗? ,理由是 ;
请设计一个简单的实验加以验证 。
(3)该药品须密封保存,若表面出现颜色变化,说明部分Fe2+已变成Fe3+。 药品中经常放入维生素C,可以延长保质期。请你解释原因 。
![]()
六、(本题共20分)
28.卤代烃在碱性醇溶液中能发生消去反应。例如
该反应也可表示为
下面是八个有机化合物的转换关系
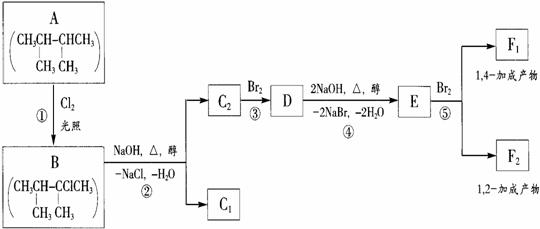 |
请回答下列问题:
(1)根据系统命名法,化合物A的名称是 。
(2)上述框图中,①是 反应,③是 反应。(填反应类别)
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式
。
E生成高分子化合物的化学方程式
(4)写出E的两种不同类型的同分异构体的结构简式 , 。
29.(1)醛(如糠醛)在碱作用下,可以发生如下反应:
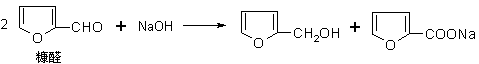
(2)不饱和碳碳键上连有羟基不稳定。
(3)化合物A~F之间的转化关系如下图所示。其中,化合物A含有醛基,E与F是同分异构体,F能与金属钠反应放出氢气。A生成F的过程中,A中醛基以外的基团没有任何变化。
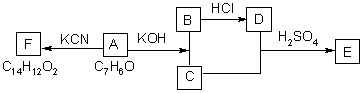
据上述信息,回答下列问题:
(1)写出A生成B和C的反应式:
(2)写出C和D生成E的反应式:
(3)F结构简式是:
(4)A生成B和C的反应是 ,C和D生成E的反应是
A.氧化反应 B.加成反应 C.消去反应 D.酯化反应 E.还原反应
(5)F不可以发生的反应有
A.氧化反应 B.加成反应 C.消去反应 D.酯化反应 E.还原反应
七、(本题共16分)
30.将含有C.H、O的有机物3.24 g,装入元素分析装置,通入足量的O2使它完全燃烧,将生成的气体依次通过氯化钙干燥管A和碱石灰干燥管B。测得A管质量增加了2.16g,B管增加了9.24g。已知该有机物的相对分子质量为108。
⑴ 推测此化合物的分子式。
⑵ 完全燃烧此化合物3.24g,须消耗氧气的质量是多少?
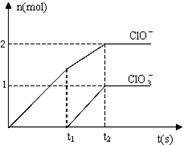 31.在一定量的石灰乳中通入一定量的氯气,生成物
31.在一定量的石灰乳中通入一定量的氯气,生成物
中含有Cl-、C1O-、C1O3-三种含氯元素的离子,
其中C1O-、C1O3-两种离子的物质的量(n)与反
应时间(t)的曲线如右图所示。已知生成C1O ![]()
化学反应方程式为:
6Ca(OH)2 6C12 → 5CaC12 Ca(C1O3)2 6H2O。
(1) 写出石灰乳中通入氯气生成次氯酸钙的化学反应方程式:
_______________________________________________________________
(2) t2时,Ca(C1O)2与Ca(C1O3)2的物质的量之和为 mol。
(3) 该石灰乳中含有Ca(OH)2的质量是_______g。
(4) 据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通入氯气的速度不同,C1O-和
C1O3-的比例也不同。若氯气与Ca(OH)2二者已恰好完全反应(发生的反应均为放热反
应),且 ![]() ,假定所得溶液为500mL,则c(C1-)为 mol/L
,假定所得溶液为500mL,则c(C1-)为 mol/L
(用含a的代数式来表示)
第一学期期末质量监控
高三化学试卷参考答案
第I卷 (共66分)
一、选择题(本题包括5小题,每小题2分,共10分,只有一个正确选项。)
题号
1
2
3
4
5
答案
D
B
C
D
D
二、选择题(本题包括12小题,每小题3分,共36分。每小题只有一个正确选项)
题号
6
7
8
9
10
11
12
13
14
15
16
17
答案
A
B
C
A
D
D
B
C
B
A
D
C
三、选择题
题号
18
19
20
21
22
答案
AC
BC
C
AC
CD
第 = 2 \* ROMAN II卷 (共84分)
四、(24分)
23.A(9分)
(1)H、Na: 281、 •Si:、S:1S22S22P63S23P4(4分,各1分)
(2)Na 、Al3 、O2-(2分,选对3个给1分。)
(3)Al2O3 2OH-→2Al O2- H2O(2分)
(4)用于制造光导纤维(或压电材料、光学仪器等)(1分,答出一种即可)
23.B(9分)
(1) (4分,各1分) Si 8 26 ;•Al: S :1S22S22P63S23P4
(2) Al3 Cl- S2- (3)HNO3 NH3 → NH4NO3 (4) 氮肥
24.(8分)(1)3,6,2,1,6 (2)N2,Si3N4
(3)1摩尔 (4)小于2,可逆反应不能进行到底。
25.(7分)(1)K=[C(C)] 3/ [C(A)] 2•[C(B)] (1分) v=0.2mol/L•min (2分)
(2)吸热 (1分) (3)2.4mol/L(2分) 不变 (1分)
五、(24分)
26.(12分)A 加热
(1)Cu 2NO3- 4 H → Cu2 2NO2↑ 2H2O( 2分)
(2)氧化 酸 ( 2分)
(3)产生红棕色气体,固体溶解( 2分)
(4)(3分)C 环保、经济
(5)冷却 过滤 ; 水解, 分解等。( 3分)
26.(12分)B
(1)氧化 酸 (2分)
|
(3)C 4HNO3 → CO2 4NO2↑ 2H2O( 2分)
(4)(3分)C 环保、经济
(5)冷却 过滤 ; 水解, 分解等。( 3分)
27.(12分)
⑴ 稀盐酸(1 分) KSCN溶液 (1分)
2Fe2++Cl2→2Fe3++2Cl- Fe3++SCN-→[Fe(SCN)]2+ (4分)
⑵不合理(1分) 氯水氧化性强,不会还原Fe3+。设计的实验为在褪色后溶液加入FeCl3溶液,仍不变红色(或在褪色后溶液加入加入KSCN溶液,变红色)(3分)
⑶维生素C有还原性(2分)
六、(20分)
28.(9分)(1)2,3-二甲基丁烷
(2)取代 加成
(3) 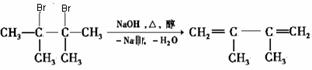
n CH2=C(CH3)-C(CH3)=CH2 → 〔-CH2-C(CH3)=C(CH3)-CH2-〕n
(4) 炔烃 二烯烃任写两个
29.(11分)(1) 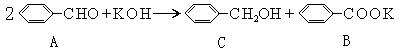
(2) 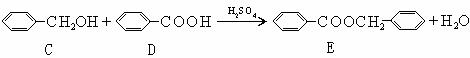
(3) ![]() (4)A、E;D (5)C
(4)A、E;D (5)C
七、(16分)
30.(6分)(1)该有机物分子式为C7H8O (3分)
(2) m(O2)=8.16g (3分)
31.(10分)
⑴ 2Ca(OH)2 2C12 →CaC12 Ca(C1O)2 2H2O (2分) ⑵ 1.5mol ⑶ 370g (每空均3分)
(4) ![]() (2分)
(2分)
