|
一.选择题
1. 106AA02 下列反应Kc的单位是( )
1. 2X(g) 2Y(g)=3Z(g)
A L·mol-1 B mol·L-1 C L2·mol2 D mol2·mol-2
2. 106AA03 下列哪一个反应的Kc和Kp的数值相等( )
A. 3H2(g) N2(g)=2NH3(g)
B. H2(g) I2(g)=2HI(g)
C. CaCO3(s)=CaO(s) CO2(g)
D. 2F2(g) 2H2O(l)=2HF(g) ,O2(g)
3. 106AA05 一定条件下,合成氨反应呈平衡状态,
3H2 N2=2NH3-------K1
eq \f(3,2) H2 eq \f(1,2) N2=NH3--------K2
则K1与K2的关系为( )
A. K1=K2 B. K22=K1
C. K12 = K2 D. 无法确定
4. 106BA02 已知: 2SO2 O2=2S3反应达平衡后,加入V2O5催化剂,则SO2的转化率( )
A. 增大 B. 不变 C. 减小 D. 无法确定
5. 106BB03 正反应能自发进行和反应达平衡的条件分别为( )
A. Qp>Kp,△G<0 B. Qp>Kp,△G>0
C. Qp<Kp,△G<0 D. Qp<Kp,△G>0
E. Qp=Kp,△G=0
6. 106BA05醋酸铵在水中存在着如下平衡:
NH3 H2O  NH4 OH- -------K1 NH4 OH- -------K1
HAc H2O  Ac- H3O -------K2 Ac- H3O -------K2
NH4 Ac-  HAc NH3-------K3 HAc NH3-------K3
2H2O  H3O OH- --------K4 H3O OH- --------K4
以上四个反应平衡常数之间的关系是( )
A. K3=K1K2K4 B. K4=K1K2K3
C. K3K2=K1K4 D. K3K4=K1K2
7. 106BB08 可逆反应,C(s) H2O  CO(g) H2(g) △H>0,下列说法正确的是( ) CO(g) H2(g) △H>0,下列说法正确的是( )
A. 达到平衡时,反应物的浓度和生成物的浓度相等
B. 达到平衡时,反应物和生成物的浓度不随时间的变化而变化
C. 由于反应前后分子数相等,所以增加压力对平衡没有影响
D. 加入正催化剂可以加快反应达到平衡的速度
E. 升高温度使V正增大,V逆减小,结果平衡向右移动
8. 107BA05 合成氨反应: N2(g) 3H2(g)  2NH3(g)的平衡常数 2NH3(g)的平衡常数 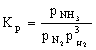 :当体系总压力增大一倍时,同温下重新建立平衡,此时: :当体系总压力增大一倍时,同温下重新建立平衡,此时: 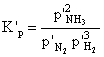 3, Kp与Kp’ 的关系为( ) 3, Kp与Kp’ 的关系为( )
A. Kp=1/4Kp’ B. Kp=4Kp’
C. Kp=Kp’ D. Kp与Kp’没有如上关系
9. 108AA04 下列因素对转化率无影响的是( )
A. 温度 B. 浓度 C. 压力(对气相反应) D. 催化剂
10. 108AA05 反应物的浓度相同,反应温度相同,反应:
(1) mA nB  pC (2) X 2Y pC (2) X 2Y  Z Z
对A和X而言,转化率大的是( )
A. X>A B. A>X C. X=A D. 无法确定
11. 108BA01 反应: A(g) B(s)  C(g),在400K时,平衡常数Kp=0.5.当平衡时,体系总压力为100kPa时,A的转化率是( ) C(g),在400K时,平衡常数Kp=0.5.当平衡时,体系总压力为100kPa时,A的转化率是( )
A. 50% B. 33% C. 66% D. 15%
12. 108BA03 已知反应N2O4(g)→2NO2(g)在873K时,K1=1.78×104,转化率为a%,改变条件,并在1273K时,K2=2.8×104,转化率为b%(b>a),则下列叙述正确的是( )
A. 由于1273K时的转化率大于873K时的,所以此反应为吸热反应
B. 由于K随温度升高而增大,所以此反应的△H>0
C. 由于K随温度升高而增大,所以此反应的△H<0
D. 由于温度不同,反应机理不同,因而转化率不同
13. 108BA04 在276K时反应: CO(g) H2O(g  ) CO2(g) H2(g)的Kc=2.6,当CO(g)与H2O(g)的浓度(mol·L-1)以何种比例(与下列各组数据接近的)混合时,可得到90%的CO的转化率( ) ) CO2(g) H2(g)的Kc=2.6,当CO(g)与H2O(g)的浓度(mol·L-1)以何种比例(与下列各组数据接近的)混合时,可得到90%的CO的转化率( )
A. 1:1 B. 1:2 C. 1:4  D. 1:5 D. 1:5
14. 108BB09 对于反应: C(S) H2O(g) CO(g) H2(g), △H>0,为了提高C(S)的转化率,可采取的措施是( )
A. 升高反应温度 B. 降低反应温度
C. 增大体系的总压力 D. 增大H  2O(g)的分压 E. 多加入C(S) 2O(g)的分压 E. 多加入C(S)
15. 213BA01 反应: 2SO2(g) O2(g) 2SO3(g), △H<0,根据勒夏特列原理,和生产的实际要求,在硫酸生产中,下列哪一个条件是不适宜的( )
A. 选用V2O5作催化剂 B. 空气过量些
C. 适当的压力和温度 D. 低压,低温
16. 213BA05 下列反应处于平衡状态, 2SO2(g) O2(g)  2SO3(g).△H=-200kJ·mol-1,欲提高平衡常数Kc的值,应采取的措施是( ) 2SO3(g).△H=-200kJ·mol-1,欲提高平衡常数Kc的值,应采取的措施是( )
A. 降低温度 B. 增大压力
C. 加入氧气 D. 去掉三氧化硫
213CB10 下列叙述正确的是( )
A. 在化学平衡体系中加入惰性气体,平衡不发生移动
B. 在化学平衡体系中加入惰性气体,平衡发生移动
C. 恒压下,在反应之后气体分子数相同的体系中加入惰性气体,化学平衡不发生移动
D. 在封闭体系中加入惰性气体,平衡向气体分子数减小的方向移
E. 在封闭体系中加入惰性气体,平衡向气体分子数增多的方向移动
17. 105BA01 下列关于催化剂作用的叙述中错误的为( )
A. 可以加速某些反应的进行 B. 可以抑制某些反应的进行
C. 可以使正逆反应速度以相等的速度加快
D. 可以改变反应进行的方向
18. 107AA05 勒沙特列原理( )
A. 只适用于气体间的反应 B. 适用所有化学反应
C, 只限于平衡时的化学反应 D. 适用于平衡状态下的所有体系
19.  107BB07 一定温度下反应: PCl5(g) PCl3(g) Cl2(g)达平衡时,此时已有50%的PCl5分解,下列方法可使PCl5分解程度增大的是( ) 107BB07 一定温度下反应: PCl5(g) PCl3(g) Cl2(g)达平衡时,此时已有50%的PCl5分解,下列方法可使PCl5分解程度增大的是( )
A. 体积增大一倍
B. 保持体积不变,加入氮气使总压力增大一倍
C. 保持总压不变,加入氮气使总体积增大一倍
D. 增大PCl5的分压 E. 降低PCl5的分压
20.  213CB09 已知下列反应的平衡常数, 213CB09 已知下列反应的平衡常数,
H2(g) S(s) H2S(g) (1) K1
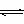 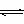 S(s) O2(g) SO2(g) (2) K2 S(s) O2(g) SO2(g) (2) K2
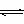 则反应: H2(g) SO2(g) O2(g) H2S(g) 和 则反应: H2(g) SO2(g) O2(g) H2S(g) 和
反应: SO2 S(s) O2(g)的平衡常数分别为( )
A. 1/K1 B. 1/K2 C. K1-K2 D. K2/K1 E. K1/K2
二.选择题
1. 106BC04 已知:
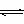 (1) H2O(g)=H2(g) eq \f(1, 2 )O2(g),Kp=8.73×10-11 (1) H2O(g)=H2(g) eq \f(1, 2 )O2(g),Kp=8.73×10-11
(2) CO2(g)=CO(g) eq \f(1, 2 )2O2(g),Kp=6.33×10-11
则反应: CO2(g) H2(g)=CO(g) H2O(g)的Kp为_________,Kc为__________
2. 106BC06 298K时,HBr(aq)离解反应的△Gø=-58kJ·mol-1,其Ka应为__________由Ka的数值说明____________________
3. 108BC05 1073K时,反应: CO(g) H2O(g)  CO2(g) H2(g)的Kc=1,在最初含有1.0molCO(g)和1.0molH2O(g)的混合物经反应达到平衡时, CO的物质的量为_________________mol,其转化率为________________ CO2(g) H2(g)的Kc=1,在最初含有1.0molCO(g)和1.0molH2O(g)的混合物经反应达到平衡时, CO的物质的量为_________________mol,其转化率为________________
108BC07 已知反应: A(g) B(g)  C(g) D(g)在450K时Kp=4,当平衡压力为100kPa时,且反应开始时,A与B的物质的量相等,则A的转化率为_____________,C物质的分压(kPa)为__________ C(g) D(g)在450K时Kp=4,当平衡压力为100kPa时,且反应开始时,A与B的物质的量相等,则A的转化率为_____________,C物质的分压(kPa)为__________
213BC09 下列反应处于平衡状态, X(g) Y(g)  4Z(g) △H=-45kJ·mol-1当同时升高温度加入正催化剂时,正反应速度将____________________,化学平衡将________________. 4Z(g) △H=-45kJ·mol-1当同时升高温度加入正催化剂时,正反应速度将____________________,化学平衡将________________.
107BC09 反应: (a) C H2O  CO H2 (b) 3H2 N2 CO H2 (b) 3H2 N2  2NH3, 在密闭容器中进行,且呈平衡状态,当温度不变时,在上述反应里加入氮气以增加总压力,对反应(a)将_______________,对反应(b)将_____________ 2NH3, 在密闭容器中进行,且呈平衡状态,当温度不变时,在上述反应里加入氮气以增加总压力,对反应(a)将_______________,对反应(b)将_____________
三.问答题
1. 108BD08 乙酸和甲醇可按下式反应:
CH3COOH CH3OH  CH3COOCH3 H2O CH3COOCH3 H2O
298K时KC=4,经过计算,(1)反应物均为1mol, (2)甲醇为1mol,乙酸为3mol时甲醇的转化率?对结果作出解释.
2. 107BD10 对反应: mA nB  pC, △H<0 ,升高温度,对反应速度和化学 pC, △H<0 ,升高温度,对反应速度和化学
平衡有何影响. 为什么?
3. 105BD08 催化剂能影响反应速度,但不能影响化学平衡,为什么?
4. 213CD07 简述在合成氨生产中: N2(g) 3H2(g)  2NH3(g). △Hø =-92.4KJ·mol-1,工业上采用温度控制在673---773K,而不是更低些,压力控制在30390kPa而不是更高? 2NH3(g). △Hø =-92.4KJ·mol-1,工业上采用温度控制在673---773K,而不是更低些,压力控制在30390kPa而不是更高?
四.计算题
1. 108BE02 在某温度下密闭容器中发生如下反应: 2A(g) B(g)  2C(g),若将2molA和1molB反应,测得即将开始和平衡时混合气体的压力分别为3×105Pa.和2.2×105Pa,则该条件下A的转化率为多少?平衡常数Kp是多少? 2C(g),若将2molA和1molB反应,测得即将开始和平衡时混合气体的压力分别为3×105Pa.和2.2×105Pa,则该条件下A的转化率为多少?平衡常数Kp是多少?
2. 316BE02 已知某反应在25℃时,Kp=5.0×1017,求此反应的△Gø.
3. 316DE01 把3体积H2和1体积N2混合加热,在10Pø条件下,达到平衡,其中NH3含3.85%(体积百分数).计算:当压力为50Pø时NH3占的体积百分数.(Pø=101.3 kPa)
4. 316DE06 反应: CO H2O  CO2 H2(均为气体)达到平衡时,Pco=40kPa , eq P\s\do4(CO2) =40kPa, P eq \s\do4(H2) = 12kPa, P eq \s\do4(H2O) =20kPa, 在恒温恒容下通入CO气体,P eq \s\do4(H2) =17 kPa,试计算新平衡下各气体的分压. CO2 H2(均为气体)达到平衡时,Pco=40kPa , eq P\s\do4(CO2) =40kPa, P eq \s\do4(H2) = 12kPa, P eq \s\do4(H2O) =20kPa, 在恒温恒容下通入CO气体,P eq \s\do4(H2) =17 kPa,试计算新平衡下各气体的分压.
5. 315CE01 设H2,N2和NH3在达平衡时总压力为500kPa,N2的分压为100kPa, H2的物质的量的分数为0.40,试计算下列几种情况的Kp值.
1. N2(g) 3H2(g)  2NH3(g) K1 2NH3(g) K1
2. NH3(g)  N2(g) H2(g) K2 N2(g) H2(g) K2
6. 315DE03 已知反应: PCl5(g)  PCl3(g) Cl2(g)523K时在2L容器中的 0.7molPCl5有0.5mol分解了,计算: PCl3(g) Cl2(g)523K时在2L容器中的 0.7molPCl5有0.5mol分解了,计算:
(1) 该温度下反应的Kc和Kp
(2) 若在上述密闭容器中又加入0.1molCl2PCl5的分解百分率是多少.
第二章 化学平衡补充习题答案
一.选择题 |
1. A |
2. B |
3. B |
4. B | |
5. c E |
6. B |
7. B D |
8. C | |
9. D |
10. D |
11. B |
12. B | |
13. C |
14. A D |
15. D |
16. A | |
17. C D |
18. 1 D |
19. D |
20. A C | |
21. E B |
|
|
| |