|
(时间120分钟,满分150分)
可能用到的相对原子质量: H:1; C:12; O:16; Na:23; Mg:24; A1:27;S:32; K:39; Fe:56;Cu:64;Ba:137;
第Ⅰ卷(选择题,共72分)
一、选择题(每小题只有一个正确答案,每题4分,共32分)
1、某无水盐在30℃时的溶解度为50g,20℃时的溶解度为20g。若将100g质量分数
为30%的该盐溶液从30℃降到20℃,析出无水晶体的质量是:
A、16 g; B、12 g; C、10 g ; D、1 g;
2、法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也
有人称之为“零号元素”。下列有关“四中子”粒子的说法不正确的是 ( )
A、该粒子不显电性; B、该粒子质量数为4;
C、在周期表中与氢元素占同一位置; D、该粒子质量比氢原子大 ;
3、向稀硫酸中加入铜粉不发生反应,若再加入下列某种盐,则铜粉可以逐渐溶解。符合此
条件的盐是 ( )
A、NaN03; B、KCl; C、ZnS04; D、FeSO4 ;
4、某白色固体可能是由①NH4Cl 、②AlCl3、③NaCl、④AgN03、⑤KOH中的一种或几种
组成。将此固体投入水中,得澄清溶液,该溶液可使酚酞呈红色,向该溶液中加稀硝酸
至过量,有白色沉淀产生。以下对原固体的判定中不正确的是:
A、肯定存在①; B、至少存在①④⑤;
C、无法确定是否有③; D、至少存在②和⑤;
5、用NA表示阿伏加德罗常数,下列叙述正确的是:
A、通常情况下5.6LH2含0.5NA个原子;
B、2.4g金属镁变为镁离子时失去的电子数为0.1NA;
C、0.5L PH=2的H2SO4溶液中含0.005NA个H ;
D、124g白磷中共价键数目为4NA个;
6、向Fe2(SO4)3 、CuCl2的混合溶液中投入足量的铁粉充分反应后,得固体经过滤、干燥、称重,知所得固体的质量与加入的铁粉质量相等,则原混合溶液中C(SO42-)与C(Cl-)之比是:
A、3:2; B、1:7; C、2:7; D、3:14;
7、在下列条件下,两种气体分子数一定相等的是:
A、同质量、不同密度的N2和C2H4;
B、同温度、同体积的O2和N2;
C、同体积、同密度的CO和C2H4;
D、同压强、同体积的N2和O2;
8、下列方案合理的是:
A、用饱和碳酸钠溶液来除去乙酸乙酯中混有的乙酸、乙醇杂质;
B、用加入浓溴水的方法来分离甲苯和苯酚的混合液;
C、用点燃的方法来除去二氧化碳中少量的一氧化碳;
D、用过滤的方法除去苯酚中的三溴苯酚;
二、选择题(每题有1~2个正确答案,每题4分,共40分)
9、将20mL 0.4mol/L硝酸铵溶液跟50mL 0.1mol/L氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是:
A 、C(NO3-)>C(OH-)>C(NH4+)>C(Ba2+);
B 、C(NO3-)>C(Ba2+)>C(OH-)>C(NH4+);
C 、C(Ba2+)>C(NO3-)>C(OH-)>C(NH4+);
D 、C(NO3-)>C(Ba2+)>C(NH4+)>C(OH-);
10、某温度下,在一容积可变的容器中,反应2A(S)十B  2C(g);△H>0,达到平衡 2C(g);△H>0,达到平衡
时,A、B、C的物质的量分别为4mol、2mol、4mol,当采取下列措施能使平衡向正反应方向移动的是:
A、升高温度; B、加入催化效果更好的催化剂;
C、A、B、C均增加1mol ; D、A、B、C的量均减半;
11、下列离子反应方程式正确的是:
A、氯气与水反应:Cl2 H2O =Cl- 2H ClO-;
B、氨气通入醋酸溶液中NH3 H =NH4 ;
C、氯化铁溶液显弱酸性:Fe3 3H2O  Fe(OH)3 3H ; Fe(OH)3 3H ;
D、碳酸氢钠溶液中加入过量石灰水HCO3- OH-=CO32- H2O;
12、分子式与苯丙氨酸[C6H5CH2CH(NH2)COOH]相同,且同时符合下列两个条件:①有带两个取代基的苯环 ②有一个硝基直接连接在苯环上的异构体的数目是:
A.3 B.5 C.6 D.10
13、某种解热镇痛药的结构简式为 当它完全水解时,可得到的产物有:
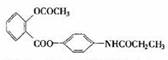 A、2种; B、3种; A、2种; B、3种;
C、4种; D、5种;
14、美国(科学)杂志报道,在40GPa高压下,用激光加热到1800 K,人们成功制得了原子晶体干冰,下列推断正确的是:
A、原子晶体干冰有很高的熔、沸点,有很大的硬度;
B、原子晶体干冰易气化,可用作制冷材料;
C、原子晶体干冰硬度大,可用作耐磨材料;
D、每摩尔原子晶体干冰中含2 mol C—O键;
15、下列叙述正确的是 :
A、常温PH=12的烧碱和PH=2的某酸溶液等体积混合,混合液的PH值≤7;
B、PH值相同氨水和烧碱溶液稀释相同倍数时,氨水PH值下降得少些;
C、同浓度盐酸中和PH值相同的氨水和烧碱溶液,所需盐酸体积相同;
D、向一定量纯水中通入少量HCl气体后,Kw值增大;
16、将一定量的Fe、Fe2O3、CuO的混合物放入体积为100mL、浓度为2.2mol·L-1的H2SO4溶液中,充分反应后,生成气体896mL(标况),得到不溶固体1.28g,过滤后,滤液中的金属离子只有Fe2 (假设滤液体积仍为100mL)。向滤液滴加2mol·L-1的NaOH溶液至40mL时开始出现沉淀。则未滴加NaOH溶液前滤液中FeSO4的物质的量浓度为:
A、2mol·L-1 B、1.8mol·L-1
C、1.9mol·L-1 D、无法计算
17、.在密闭容器中,aA(气)  bB(气)达平衡后,保持温度不变,将容器体积增加1倍,当达到新平衡时,B的浓度是原来的60%,下列说法正确的是: bB(气)达平衡后,保持温度不变,将容器体积增加1倍,当达到新平衡时,B的浓度是原来的60%,下列说法正确的是:
A、平衡向正反应方向移动了;
B、物质A的转化率减少了;
C、物质B的质量分数增加了;
D、a>b;
18、在常温下,下列可逆反应的平衡移动伴随着颜色变化,但颜色变化不受压强变化的是:
A、2NO2 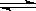 N2O4; B、2NO2 N2O4; B、2NO2 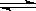 2NO+O2; 2NO+O2;
C、2HI 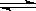 H2+I2; D、FeCl3+3KSCN H2+I2; D、FeCl3+3KSCN 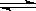 Fe(SCN)3+3KCl Fe(SCN)3+3KCl
第Ⅱ卷(共78分)
三、(本题为2小题,共22分)
19、把淀粉溶液溶于沸水中,制成淀粉胶体。
⑴鉴别水溶液和胶体可以利用的方法是
。
⑵60℃左右时,在淀粉胶体中加入淀粉酶,充分反应。然后把反应后的全部液体装入半透膜里,系紧袋口,并把它悬挂在盛有蒸馏水的烧杯里。从半透膜袋里析出的物质是 ,该操作的名称是 。
20、图12是化学实验室中制氯气的发生装置。制氯气时,可以通过控制分液漏斗中液体的流速来调节反应速率,但不能使气体的产生随时停止。
(1)写出实验室制氯气的化学方程式______________________________________。
收集方法_____________________干燥剂______________________。
(2)某实验小组想利用图12实验装置加以改装来制取CO2,并保证实验过程中既能控制反应速率,又能使气体的放出随时停止。可供选择的药品和用品:浓盐酸、稀盐酸、稀硫酸、碳酸钠粉末、大理石颗粒、铜网、穿有铜丝的双孔软木塞(铜丝可上下移动)等。
①所选择的药品是___________________________。
②实验装置如何改装:____________________________。 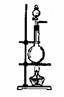
③停止制气时的实验操作方法是_________________________。
四(18分)
21、某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:
H2A 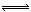 H HA- HA- H HA- HA- 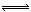 H A2- H A2-
已知相同浓度时的电离程度:a(H2A)>a(HA-),设有下列四种溶液:
A、0.01mol/L的H2A溶液;
B、0.01mol/L的NaHA溶液;
C、0.01mol/L的HCl与0.04mol/L的NaHA溶液等体积混合液;
D、0.02mol/L的NaOH与0.02 mol/L的NaHA溶液等体积混合液;
据此,填写下列空白(填代号)
(1)C(H )最大的是__________________,最小的是______________________。
(2)C(H2A)最大的是_________________,最小的是______________________。
(3)C(A2-)最大的是_________________, 最小的是______________________。
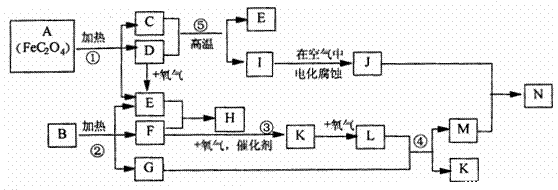
22、已知:D.E.F.K.L为气体,E能使澄清石灰水变浑浊,1是金属,1molA在反应①中转移的电子的物质的量为1mol,B.H是常见的化肥,它们有如下图所示转化关系(部分反应中生成的水已略去):试回答下列:
(1)写出化学方程式;C__________D _____________H ____________N ______________
(2)写出反应方程式
②___________________________ ③ ___________________________
④ ___________________________
(3)写出离子反应方程式 I M—N K:____________________________
五、(本题包括2小题,共18分)
23、A、B、C、D均为含苯环的化合物,且式量B>A>C,已知有机物A的结构简式为: 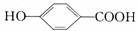
(1)A既能和NaOH溶液反应,又能和NaHCO3溶液反应,写出A和 NaHCO3溶液反应的化学方程式________________________。
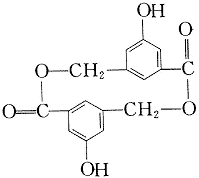
(2)有机物B在浓H2SO4存在条件下,相互作用生成一种环状酯(如下图)则有机物B的结构简式为________。等物质的量B与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、NaHCO3的物质的量之比为________。
(3)D和B互为同分异构体,且知苯环上的一氯代物只有两种,D不与NaHCO3反应,能与Na和NaOH反应,等质量的D消耗Na和NaOH的物质的量之比为2∶3,则D的结构简式为________。(只写一种)
(4)1molA、C完全燃烧,消耗O2的质量相等,且1molC能和1molNa完全反应,写出含碳原子数最少的C的结构简式________。
24、已知RCH=CH2 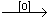 RCH2CHO,下图表示有机物A、B等发生一系列反应的变化关系: RCH2CHO,下图表示有机物A、B等发生一系列反应的变化关系:
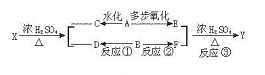
其中X与Y互为同分异构体,其分子式为C6H12O2,F与C,D与E分别互为同系物,A的密度在标准状况下为1.25g·L-1。请回答下列问题:
(1)写出结构简式B_____________________或____________________。
(2)写出反应类型反应①___________________;反应②_____________________;
反应③____________________。
(3)写出反应③的化学方程式:______________________________。
五、计算题(20分)
25、在一定条件下,使H2和O2的混合气体26g充分发生反应。所得产物在适当温度下跟足量的固体Na2O2反应,使固体增重2g。求原混合气体中O2和H2的质量。
26、现有Fe、Cu组成的合金,其中Cu、Fe的总物质的量为a mol,Cu的物质的量分数为x;研成粉末后,全部投入含b molHNO3的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:
(1)若剩余的残渣只有Cu,则溶液中含有的金属离子为___________________________。(写出所有可能情况)
(2)当溶液中金属离子只有Fe2 、Cu2 时,则b的取值范围是(用a、x表示)______________。
(3)当x=0.5时,溶液中Fe3+与Fe2+的物质的量相等时,在标准状况共产生672 mL气体。求a、b的值。
化学模拟试卷答案 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 | |
A |
C |
A |
D |
C |
D |
A |
A |
B | |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 | |
C |
C |
C |
C |
AC |
AB |
B |
AC |
D | |