| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
根据以上信息,回答下列问题: (1)元素C在元素周期表中的位置是 周期 族;D的电子排布式为: 。 (2)A和D的氢化物中,沸点较高的是 ,原因是 ;A和B的离子中,半径较小的是 (填离子符号)。
 (3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如右图所示(阳离子用“●”表示,位于该正方体的顶点或面心;阴离子用“〇”表示,均位于小正方体中心)。该化合物的电子式是 。 (3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如右图所示(阳离子用“●”表示,位于该正方体的顶点或面心;阴离子用“〇”表示,均位于小正方体中心)。该化合物的电子式是 。
(4)A和E化合物的晶胞1/8的体积为2.0×10-23cm3,求A和E组成的离子化合物的密度,请列式并计算(结果保留一位小数):_______________________________。 10.(07年山东潍坊二模)在元素周期表中,一稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的A、B、C、D四种元素,它们的原子的最外层电子数依次为2、2、1、7,其中A、C两元素原子的次外层电子数为8,B、D两元素原子的次外层电子数为18,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高。 (1)B元素在周期表中的位置 。 (2)E的气态的氢化物在同族元素中沸点最同的原因是 。 (3)A、C两元素第一电离能 > 。(填元素符号) (4)B元素能形成多种配全物。元素之间形成配合物的条件是:一方是能够提供孤对电子的原子,另一方是 的原子。 11.(07年广东汕头二模)在极性分子中,正电荷重心同负电荷重心间的距离称偶极长,通常用d表示。极性分子的极性强弱同偶极长和正(或负)电荷重心的电量(q)有关,一般用偶极矩(μ)来衡量。分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=d·q。试回答以下问题: (1)HCl、CS2、H2S、SO2四种分子中μ=0的是 ; (2)对硝基氯苯、邻硝基氯苯、间硝基氯苯,3种分子的偶极矩由大到小的排列顺序是: ; (3)实验测得:μPF3=1.03、μBCl3=0。由此可知,PF3分子是 构型, BC13分子是 构型。 (4)治癌药Pt(NH3)2Cl2具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个角上。已知该化合物有两种异构体,棕黄色者μ>0,淡黄色者μ=0。试画出两种异构体的构型图,并比较在水中的溶解度。 构型图:淡黄色者 ,棕黄色者 ;在水中溶解度较大的是 。
试回答下列问题: (1)22Ti元素基态原子的价电子层排布为 ; (2)在Ti的化合物中,可以呈现 2、 3、 4三种化合价,其中以 4价的Ti最为稳定; ①偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如右图,它的化学式是 ; ②已知Ti3 可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一为绿色,但相关实验证实,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验: a.分别取等质量的两种配合物晶体的样品配成待测溶液; b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀; c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的 则绿色晶体配合物的化学式为 ,绿色晶体中含有化学键类型是 。 13.(07年山东济宁第一次摸底)下表为元素周期表前三周期的一部分。
|
|
|
| Z
|
|
| Y
|
| R
| | |||||||||||||||||||||||
(1)X的氢化物的沸点与W的氢化物的沸点比较: > (填化学式),原因是 。
(2)选出X的基态原子的原子轨道表示式 ,另一原子轨道表示式不能作为基态原子的轨道表示式是因它不符合 。(填序号)。
|
↑ ↑ ↑ |
|
|
|
↑↓ ↑ |
|
|
A. B.
1s 2s 2p 1s 2s 2p
C.泡利原理 D.洪特规则
(3)以上五种元素中, (填元素符号)元素原子失去核外第一个电子需要的能量最多。
(4)由以上某种元素与氢元素组成的三角锥形分子E和由以上某种元素组成的直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10),反应如图中所示,则下列判定错误的是 (填编号)。
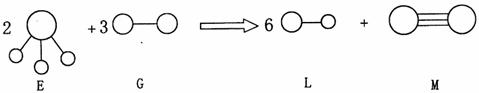
A.G是活泼的非金属单质
B.L是极性分子
C.E的中心原子杂化轨道类型为sp2杂化
D.M的化学性质比同主族相邻元素单质的化学性质活泼
E.M分子中有1个 ![]() 键,2个
键,2个 ![]() 键
键
14.(07年山东滨州第四次质量检测)有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7:8、E与B的质量比为1:1。根据以上条件,回答下列问题:
(1)写出D元素原子的电子排布式 ;
(2)写出AB2的结构式 ,其晶体类型属于 其中A的杂化方式为 ;
(3)将B、C、D、E元素按第一电离以由小到大的顺序排列(填写元素符号)
;
(4)熔点比较:B的氢化物 E的氢化物(选填“<”“=”“>”),并解释原因:
。
15.(07年山东济南3月统考)有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已布满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2∶1。
请回答下列问题:
(1)A元素形成的晶体属于A2密堆积型式,则其晶体内晶胞类型应属于 (填写“六方”、“面心立方”或“体心立方”)。
(2)B-的电子排布式为 ,在CB3分子中C元素原子的原子轨道发生的是 杂化。
(3)C的氢化物的空间构型为 ,其氢化物在同族元素所形成的氢化物中沸点最高的原因是 。
|
D2- |
|
A+ |
 (4)B元素的电负性 D元素的电负性(填“>”、“<”或“=”);用一个化学方程式说明B、D两元素形成的单质的氧化性强弱: 。
(4)B元素的电负性 D元素的电负性(填“>”、“<”或“=”);用一个化学方程式说明B、D两元素形成的单质的氧化性强弱: 。
(5)如图所示是R形成的晶体的晶胞,设晶胞的棱长为a cm。试计算R晶体的密度为 。(阿伏加德罗常数用NA表示)
16.(07年山东济南4月统考)A、B、C、D四种元素处于同一周期,在同族元素中,A的气态氢化物的沸点最高,B的最高价氧化物对应的水化物的酸性在同周期中的最强的,C的电负性介于A、B之间,D与B相邻。
(1)C的原子的价电子排布式为 。
(2)A、B、C三种元素原子的第一电离能由大到小的顺序是(写元素符号) 。
(3)B的单质分子中存在的 个π键。
(4)D和B形成一种超硬、耐磨、耐高温的新型化合物,该化合物属于 晶体,其硬度比金刚石 (填“大”或“小”)。
(5)A的气态氢化物的沸点在同族中最高的原因是 。
17.(07年山东菏泽期末)A、B、C、D四种元素的原子序数均小于18,其最高正价数依次为1、4、5、7,已知B的原子核外次外层电子数为2。A、C原子的核外次外层电子数为8。D元素的最高价氧化物对应的水化物是已知含氧酸中最强的酸。则:
(1)写出C元素原子的价电子轨道表示式 。
写出D元素原子的电子排布式 .
(2)已知B与氢元素形成的化合物在标准状况下的密度为1.161g·L-1,则在该化合物分子中B原子的杂化方式 ,在该化合物分子中含有 个π键,含有 个σ键。
(3)已知C、D两元素形成的化合物通常有CD3、CD5两种。这两种化合物一种为非极性分子,另一种为极性分子,则属于极性分子的化学式为 ,该分子的空间构型为 。
(4)在A、D两元素形成的化合物组成的晶体中,阴、阳离子具有或近似具有球型对称结构,它们可以被看作刚性圆球,并彼此“相切”。如下图所示为A和D形成的化合物的晶胞结构图及晶胞的剖面图:
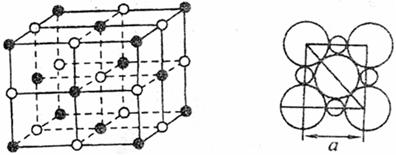
若a=5.6×10-8cm,则该晶体的密度为 g·cm-3(精确到小数点后1位)
18.(07年山东威海模拟)现有下列第2、3周期元素性质的部分数据,其中X数值是表示不同元素的原子在分子内吸引电子的能力大小,若X值越大,元素的非金属性越强,金属性越弱。X值相对较大的元素在所形成的分子中化合价为负价。
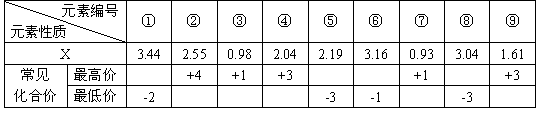
(1)写出元素⑥在周期表中的位置 。
(2)元素⑦和元素⑨两种元素的氢氧化物反应的离子方程式为 。
(3)“神舟”五号飞船内需要有一种化合物来吸收航天员呼出的 ![]() ,你认为该物质应该是由上表中的 (填序号)元素组成的。
,你认为该物质应该是由上表中的 (填序号)元素组成的。
(4)将8g元素②的单质在足量的元素①的单质中燃烧,所得气体通入1L1mol·L-1的NaOH溶液中,完全吸收后,溶液中离子浓度的大小顺序是 。
19.(07年广东佛山质量检测一)人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家猜测为是钛(Ti)。钛外观似钢,具有银灰光译。钛的特性是强度大,密度小(4.51g/cm3),硬度大,熔点高(1675℃),自1791年英国牧师格列高尔发现钛至今,钛和钛的合金已被广泛用于制造飞机、火箭、卫星、宇宙飞船、舰艇、汽轮机、化工设备、电讯器材、人造骨骼等,被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第 周期,第 族;其基态原子的价电子层排布为 。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。
①偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如下图,它的化学式是 。
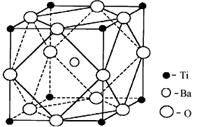
②已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一为绿色,但相关实验证实,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品样配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。
则绿色晶体的化学式为 ,绿色晶体中含有的化学键类型是 ,该配合物中的配位体是 。
20.(07年广东佛山质量检测二)短周期元素A、B、C、D。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P亚层中有3个未成对电子。
(1)C原子的电子排布式为 ,若A为非金属元素,则按原子轨道的重迭方式,A与C形成的化合物中的共价键属于 键(填“σ”或“π”)。
(2)当n=2时,B位于元素周期表的第 周期 族,BC2属于 分子(填“极性”或“非极性”)。当n=3时,B与C形成的晶体属于 晶体。
(3)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2, A、B、C、D四种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
21.(07年山东青岛摸底)有A、B、C、D、E五种元素,其中A、B、C、D为短周期元素,A元素的周期数、主族数、原子序数相同;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同;C原子的价电子构型为csc cpc 1,D元素的原子最外层电子数比次外层电子数少2个,D的阴离子与E的阳离子电子层结构相同,D和E可形成化合物E2D。
(1)上述元素中,第一电离能最小的元素的原子结构示意图为 ;D的电子排布式为 ;
(2)下列分子结构图中的 ![]() 和
和 ![]() 表示上述元素的原子中除去最外层电子的剩余部分, 小黑点表示没有形成共价键的最外层电子,短线表示共价键。
表示上述元素的原子中除去最外层电子的剩余部分, 小黑点表示没有形成共价键的最外层电子,短线表示共价键。
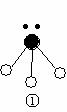
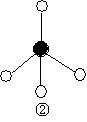
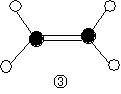
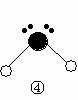
则在以上分子中,中心原子采用sp3杂化形成化学键的是 (填写分子的化学式); 在③的分子中有 个σ键和 个π键。
(3)A、C、D可形成既具有离子键又具有共价键的化合物,其化学式可能为 ;C的氢化物水溶液与足量AgNO3 溶液反应生成的配合物,其化学式为 ,请说出该配合物中中心原子与配位体及内界与外界之间的成键情况: 。
22.(07年山东临沂质量检测)化合物YX2、ZX2中X、Y、Z都是前三周期元素,X与Y同周期,Y与Z同主族,Y元素的最外层中P轨道上的电子数等于前一电子层电子总数,X原子最外层的P轨道中有一个轨道填充了2个电子。则
(1)X原子的电子排布式是 ,Y原子的价层电子轨道表示式是 。
(2)YX2的分子构型是 ,YX2的熔沸点比ZX2 ,(选填“高”或“低”),理由是
(3)YX2分子中,Y原子的杂化类型是 ,一个YX2分子中含 个π键。
(4)下图表示一些晶体的结构(晶胞),其中代表YX2的是
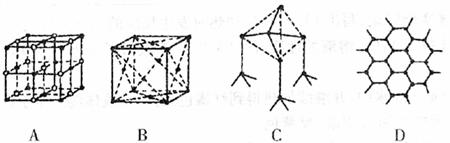
23.(07年山东淄博二次摸底)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
|
a |
|||||||||||||||||
|
b |
c |
d |
e |
f |
|||||||||||||
|
g |
h |
i |
j |
k |
l |
m | |||||||||||
|
n |
o |
||||||||||||||||
试回答下列问题:
(1)请写出元素o的基态原子电子排布式 ①
(2)d的氢化物的分子构型为 ② ,中心原子的杂化形式为 ③ ;k在空气中燃
烧产物的分子构型为 ④ ,中心原子的杂化形式为 ⑤ ,该分子是 ⑥ (填“极性”或“非极性”)分子。
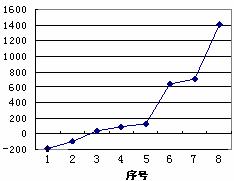
(3)第三周期8种元素按单质熔点高低的顺序如
右图,其中序号“8”代表 ⑦ (填元素符号);其中电负性最大的是 ⑧ (填右图中的序号)。
(4)由j原子跟c原子以1 : 1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比熔点更高的是 ⑨ ,试从结构角度加以解释: ⑩
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间 相互位置关系的平面图如下图丙所示。
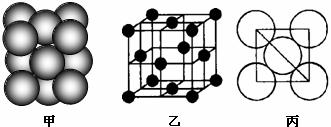
若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
①晶胞中i原子的配位数为___ eq \o\ac(○,11)11____ ,一个晶胞中i原子的数目为_ eq \o\ac(○,12)12 _。
②该晶体的密度为____ eq \o\ac(○,13)13___(用字母表示)。
24.(07年山东淄博二次摸底)有A、B、C、D、E、F、G七种元素,除E为第四面期元素外其余均为短周期元素。A、E、G位于元素周期表的s区,其余元素位于p区,A、E的原子外围电子层排布相同,A的原子中没有成对电子;B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同;C元素原子的外围电子层排布式为nsnnpn 1;D元素的第一电离能列同周期主族元素第三高;F的基态原子核外成对电子数是成单电子数的3倍;G的基态原子占据两种外形的原子轨道,且两种外形轨道中.的电子总数均相同。回答下列问题:
(1)写出下列元素的符号:D ① ,G ② ;
(2)D的前一元素第一电离能高于D的原因: ③ ;
(3)由A、B、C形成的ABC分子中,含有 ④ 个σ键, ⑤ 个π键;
(4)由D、E、F、G形成的盐E2DF4、GDF4的共熔体在冷却时首先析出的物质是 ⑥ (写化学式),原因是 ⑦ ;
参考答案
1.(1)5(2)1s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1) 4 正四面体 原子(3)HClO NH3·H2O
2.(1)1s22s22p63s23p6(2)HCl,H2S,V,极性(3)H2O2,2H2O2=2H2O+O2↑(4)CH4O
3.(1)N (2)Cl;K(3)Fe;1s22s22p63s23p63d64s2或[Ar]3d64s2(4)Cu;1s22s22p63s23p63d104s1或[Ar]3d104s1。
点评:(1) A元素基态原子的最外层有3个未成对电子,次外层有2个电子,该元素最外层还有2个2S电子,因此A元素应为氮N。(2) B元素负一价离子与氩电子层结构相同B元素为氯Cl,C元素正一价离子与氩电子层结构相同,C元素为钾K。(3) D元素的正三价离子的3d亚层为丰布满则D原子就应为3d64S2即26号元素铁Fe,铁基态原子的电子排布式为 1S22S22P63S23P63d64S2。(4) E元素基态原子的M层全布满,N层没有成对电子,只有1个未成对电子,则E原子就应为3d104S1即29号铜元素Cu,铜基态原子的电子排布式为1S22S22P63S23P63d104S1。
4.(1)1s22s22p4,σ 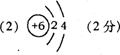 ,分子,共价键或极性共价键(3)第2周期I A族,O>P>Si>Li
,分子,共价键或极性共价键(3)第2周期I A族,O>P>Si>Li
5. 
6.(1)+3;(2)极性,NH3中有一对孤对电子,它对成键电子的排斥作用强于成键电子之间的排斥作用,当孤对电子与H+结合形成配位键形成NH4+后,孤对电子成为成键电子,四个键等同,斥力也等同。所以HNH键的键角就由107°转变为109°28’(3)不能有sp3杂化轨道(或只能有sp和sp2杂化轨道)(4)18 32 原子晶体是原子之间是以共价键结合的,共价键有饱和性和方向性,一个原子不能形成12条共价键,所以原子晶体就不能形成配位数是12的最密堆积结构。
(5) EQ \F(21 EQ \R(,3),4NA r3) g/cm3
7.(1)①②③④(2)蒸发、结晶;KCl、MgCl2;工业上冶炼金属钾和镁(3)2Cl-+2H2O ![]() 2OH-+H2↑+Cl2↑;粗盐中含有泥沙及
2OH-+H2↑+Cl2↑;粗盐中含有泥沙及 ![]() 等杂质,在碱性溶液中会形成沉淀,损坏离子交换膜;BaCl2溶液(4)NaOH+SO2=NaHSO3
等杂质,在碱性溶液中会形成沉淀,损坏离子交换膜;BaCl2溶液(4)NaOH+SO2=NaHSO3
8.(1)3S23P5(2)F<Cl<Al<Na(3)HF分子间存在氢键(4)12(5)3.2g·cm-3
9.(1)第三,ⅢA,1s22s22p63s23p5 (2)A;A的氢化物分子间可以形成氢键,而D的氢化物不能;Na+(3) ![]() (4)
(4) ![]() =3.2g/cm-3
=3.2g/cm-3
10.(1)第4周期第ⅡB族(2)E的气态氢化物分子间含有氢键,破坏它需要较高的能量,所以熔沸点较高(3)Ca K(4)具有能够接受弧对电子的空轨道
11.(1)CS2(2)邻>间>对(3)三角锥形 平面三角形
(4) 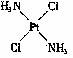 ;
; 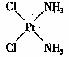 ;棕黄色者
;棕黄色者
12.(1)3d24s2(2)①BaTiO3②[TiCl(H2O)5]Cl2·H2O 离子键、配位键、极性共价键
13.(1)NH3;PH3;氨分子之间还能形成氢键(2)B;D(3)Ar(4)CD
14.(1)1s22S22p63s23p2(2)O=C=O 分子晶体 sp1 (3)Si<S<O<N (4)> H2O与H2S的晶体虽然同为分子晶体,但H2O分子间存在较强的氢键,H2S分子间只有策弱的范德华力。
15.(1)体心立方(2)ls22s22p63s23p6,sp3(3)三角锥形;氨分子间形成氢键,所以氨气比同族其它元素形成的氢化物沸点高(4)>;H2S+Cl2=2HCl+S↓ (5) ![]()
16.(1)3s22p4(2)F>N>O(3)2 (4)原子 大 (5)氟化氢分子之间轻易形成氢键
17.(1) ![]() ;1s22s22p63s23p5;(2)sp1;2;3;(3)PC13;三角锥型;(4)2.2
;1s22s22p63s23p5;(2)sp1;2;3;(3)PC13;三角锥型;(4)2.2
18.(1)三周期,VII主族(2)Al(OH)3 OH-= [Al(OH)4]-或Al(OH)3 OH-=AlO2- 2H2O
(3)①⑦(4)c(Na )>c(HCO3-)>c(CO32-)>c(OH-)>c(H )
19.(1)四面期;ⅣB族;3d24s2(2)①BaTiO3; ②绿色晶体的化学式是[TiCl(H2O)5]Cl2·H2O;离子键、极性共价键、配位键;H2O、Cl-。
20.(1)1s22s22p4 ,σ(2)二; = 4 \* ROMAN IVA;非极性;原子 (3)O>P>Si>Li
21.(1)1s22s22p63s23p4 (2)NH3、CH4、H2S; 5; 1 (3)(NH4) 2S(或 NH4HS); [Ag(NH3) 2]OH ;中心原子与配位体之间以配位键相结合(1分),内界与外界之间以离子键相结合
22.(1)1S22S22P4 , ![]() (2)直线 低 由于CO2形成分子晶体,SiO2为原子晶体,故熔沸点SiO2>CO2(3)SP 2(4)B
(2)直线 低 由于CO2形成分子晶体,SiO2为原子晶体,故熔沸点SiO2>CO2(3)SP 2(4)B
23.① 1s22s22p63s23p63d64s2 ② 三角锥形 ③ sp3 ④角形(或V形) ⑤ sp2 ⑥ 极性 ⑦ Si ⑧ 2 ⑨ SiC(或jc,或前者)⑩ 因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高。 eq \o\ac(○,11)11 12 eq \o\ac(○,12)12 4 eq \o\ac(○,13)13 EQ \F(M,4 EQ \R(,2)d3NA)
24. ①S ②Mg ③ D的前一元素是P,P的3p能级为半布满状态的3p3,是稳定结构;而S元素的3p能级3p4,是不稳定的结构。故P的第一电离能高于S④2 ⑤ 2 ⑥ MgSO4 ⑦ MgSO4的晶格能大于K2SO4的晶格能。说明:(3)由A、B、C形成的ABC分子为HCN,结构式为H—C≡N。
| |