| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
下列离子检验的方法不合理的是 A.NH4+-气体法 B.I--沉淀法 C .Ca2+-气体法 D. Fe3+-显色法 5.下列表述中,正确的是 A.H H→H2是吸热过程 B.生成单质的反应一定是氧化反应 C.凡是能自发进行的反应,一定是△H<0、△S>0 D.在可逆反应中,若正反应速率减小,逆反应速率也可能减小 6.将纯水加热至较高温度时,下列叙述正确的是 A.水的离子积变大、pH变小、呈中性 B.水的离子积不变、pH不变、呈中性 C.水的离子积变小、pH变大、呈碱性 D.水的离子积变大、pH变小、呈酸性 7.已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内 装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是
|
| ①
| ②
| ③
|
| A
| 黄绿色
| 橙色
| 蓝色
| 白色
| B
| 无色
| 橙色
| 紫色
| 白色
| C
| 黄绿色
| 橙色
| 蓝色
| 无色
| D
| 黄绿色
| 无色
| 紫色
| 白色 |
8.一定温度下,在质量都是50 g的五份水中分别加入30g、40g、50g、60g、70gKNO3固体,充分搅拌后,滤去未溶解的KNO3。加入的KNO3质量与相应所得溶液的质量数据见下表:
加入KNO3的质量/ g
30
40
50
60
70
溶液质量/ g
80
90
100
105
105
则该温度下KNO3的溶解度是
A.60克 B.80克 C.100克 D.110克
9.有M、N两溶液,各含有下列十四种离子中的七种离子: Al3 、Cl-、Na 、K 、NO3-、OH-、S2-、MnO4-、Fe3 、NH4 、H 、SO42-、CO32-、AlO2-。已知两溶液所含离子各不相同,M溶液里的阳离子只有两种,则N溶液里的阴离子应该是
A.OH-、S2-、CO32- B. AlO2-、MnO4-、SO42-
C.Cl-、NO3-、SO42- D. MnO4-、SO42-、NO3-
10.科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应为:
A.H2+2OH-=2H2O+2e- B.O2+4H++4e-=2H2O
C.H2=2H++2e- D.O2+2H2O+4e-=4OH-
二、选择题(本题包括10小题,每小题4分,共40分。每小题有个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错一个,该小题就为0分)
11.阿伏加德罗常数约为6.02×1023mol-1。下列叙述中正确的是
A.标准状况下,2.24L苯中约含有3.612x1023个碳原子
B.常温常压下,氧气和臭氧的混合物16g中约含有6.02×1O23个氧原子
C.25℃时,1 L pH=13的氢氧化钠溶液中约含有6.02×l023个氢氧根离子
D.0.5mol CH4中约含有3.01×1024个电子
12.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍。下列说法正确的是
A.X的氢化物溶于水显酸性 B.Y的氧化物是离子化合物
C.Z的氢化物的水溶液在空气中存放不易变质
D.X和Z的最高价氧化物对应的水化物都是弱酸
13.化学与数学有着密切的关系,将某些化学知识用数轴表示,可以收到直观形象、简明易记的效果。下列用数轴表示的化学知识中正确的是
A.分散系的分类: ![]()
B.常温条件下,酚酞的变色范围: ![]()
C.HCl和NaAlO2溶液反应后铝元素的存在形式:
![]()
![]() \s
\s
D.CO2通入澄清石灰水中反应的产物: ![]()
14.下列说法正确的是
A.若酸性HA>HB,则相同条件下,溶液的pH大小为NaA>NaB
B.相同条件下将pH=11的NaOH溶液和氨水分别稀释成pH=9的溶液,所加水的体积前
者大
C.pH=3的醋酸与pH=11的NaOH溶液等体积混合时,溶液中离子浓度的大小顺序是
C(Na+)>C(CH3COO—) >C(OH—) >C(H+)
D.在0.1mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H )
15.三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成
ClO-,把二价镍氧化为三价镍。以下说法正确的是
A.可用铁作阳极材料 B.电解过程中阳极四周溶液的pH明显升高
C.阳极反应方程式为:2Cl--2e-=Cl2↑
D.1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
16.下列离子方程式中正确的是
A.硫化亚铁放入盐酸中 S2- 2 H = H2S ↑
B.硫酸铜溶液中通入硫化氢 Cu2 H2S = CuS↓ 2 H
C.氯化铝溶液中加入过量氯水 Al3 4NH3•H2O = AlO2- 4NH4 2H2O
D.碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3- OH- = CO32- H2O
17. 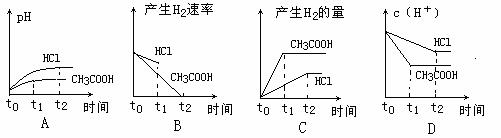 1LpH = 2的盐酸和醋酸溶液中,分别投入0.65g锌粒,则下图比较符合客观事实的是:
1LpH = 2的盐酸和醋酸溶液中,分别投入0.65g锌粒,则下图比较符合客观事实的是:
18.实验测得气态无水氯化铝在1.01×105Pa、不同温度(t3>t2>t1)时的密度( ![]() )和气体摩尔体积(Vm)为
)和气体摩尔体积(Vm)为
t/℃
t1
t2
t3
![]() /g·L—1
/g·L—1
5.00
2.67
1.48
Vm/L·mol—1
53.4
70.0
90.0
可见,t2℃时无水氯化铝存在形式的化学式为
|
19.有下列五个化学方程式(X、Y、Z均为正值):
![]() ①C2H2(g) H2(g) C2H4(g)
①C2H2(g) H2(g) C2H4(g)
|
|
![]() ③C(s) 2H2(g) CH4(g);△H=-X kJ·mol—1
③C(s) 2H2(g) CH4(g);△H=-X kJ·mol—1
![]() ④C(s)
④C(s) ![]() H2(g)
H2(g) ![]() C2H2(g);△H=-Y kJ·mol—1
C2H2(g);△H=-Y kJ·mol—1
![]() ⑤C(s) H2(g)
⑤C(s) H2(g) ![]() C2H4(g);△H=-Z kJ·mol—1
C2H4(g);△H=-Z kJ·mol—1
当温度下降时①式平衡向右移动,②式平衡向左移动。据此判定③—⑤式中关于X、Y、Z的大小顺序排列正确的是
A.X>y>Z B.X>Z>Y C.Y>X>Z D.Z>X>Y
20.水热法制备Fe3O4纳米颗粒的反应是3Fe2 2S2O ![]() O2 xOH—
O2 xOH— Fe3O4 S4O ![]() 2H2O下列说法中,正确的是
2H2O下列说法中,正确的是
A.每生成1mol Fe3O4,反应转移的电子总数为4mol B.Fe2 和S2O ![]() 都是还原剂
都是还原剂
C.1mol Fe2 被氧化时,被Fe2 还原的O2的物质的量为1/3mol
D.x=2
第Ⅱ卷 非选择题(共80分)
三、(本题包括3小题,共29分)
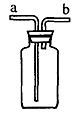 21.(6分)如图所示装置是化学实验中常用的仪器,可用于气体收集和除杂等。请根据实验目的完成下表(可以不填满):
21.(6分)如图所示装置是化学实验中常用的仪器,可用于气体收集和除杂等。请根据实验目的完成下表(可以不填满):
|
实验目的 |
瓶中加入的试剂 |
气体入口(填a或b) |
|
收集NO |
||
|
收集SO2 |
||
|
除去HBr中的Br2 |
22. (9分) 学习了元素周期律后,同学们对第四面期过渡元素氧化物产生了浓厚的爱好。是否只有二氧化锰能催化氯酸钾受热分解?氧化铁、氧化铜、氧化铬等对氯酸钾的受热分解有没有催化作用?对此他们进行了实验探究。请你根据要求完成下列部分实验报告。
I 课题名称:____________________________________________________________
II实验仪器及试剂:实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、大试管、酒精灯、计时器(或秒表)等。
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
III 实验步骤:略
IV 实验数据:
实验
编号
KClO3(g)
氧化物
产生气体(mL)
耗时(s)
化学式
质量(g)
回收
(已折算为标况)
1
0.60
-
-
-
10
480
2
0.60
MnO2
0.20
90%
67.2
36.5
3
0.60
CuO
0.20
90%
67.2
79.5
4
0.60
Fe2O3
0.20
90%
67.2
34.7
5
0.60
Cr2O3
0.20
异常
67.2
188.3
V 实验讨论:(1)实验编号3的实验中KClO3的分解率为_________%(保留一位小数)
(2) 在用Cr2O3 做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色。该刺激性气体是________(填分子式),可用______________试纸检验。上述异常现象产生的原因是____________ _______________________。
VI 实验结论:_____________________________________________________________
23.(14分)为测定碳酸钙纯度(设含杂质SiO2),同学们设计了如下几个实验方案,请回答每个方案中的问题。
[方案I](1)称取碳酸钙样品 M g;(2)加入过量盐酸;
(3)收集并测定生成的气体体积 V mL。
问题:假如称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸钙的纯度会 (偏高、偏低、无影响)
[方案II](1)称取碳酸钙样品 M g;(2)用c mol/L 盐酸 V mL(过量)溶解样品;(3)取溶解后的溶液 ![]() mL,用c/ mol/L NaOH溶液滴定,恰好用去V′mL。
mL,用c/ mol/L NaOH溶液滴定,恰好用去V′mL。
问题1:列出本实验中所用到的仪器名称(除铁架台及附件、烧杯之外)
。
问题2:加盐酸后是否需要滤出SiO2后再用NaOH滴定 (填选项编号)。
A.需要 B.不需要 C.均可
[方案III](1)称取碳酸钙样品 M g;
(2)把样品高温(1000℃)煅烧直至质量不再发生变化,冷却后称量,质量为M/ g。
问题1:为什么要煅烧至1000℃且“直至质量不再改变”? ;
问题2:本方案中的“冷却”应如何操作 。
[方案IV](1)称取碳酸钙样品 M g;(2)加入足量c mol/L盐酸V mL使之完全溶解;(3)过滤并取滤液;(4)在滤液中加入过量c′mol/L Na2CO3溶液V′mL;(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M/ g。
问题1:此方案中不需要的数据是 (填选项编号)。
A.c、V B.c′、 V′ C. M′ D. M
问题2:为减少实验误差,必要的操作是 (填选项编号)。
A.精确测定Na2CO3溶液体积V′mL B.精确配制浓度c′mol/L Na2CO3溶液
C.将步骤(3)所得沉淀洗涤,洗涤液也应并入(4)中
D.将步骤(3)所得沉淀洗涤、干燥、称量其质量M′g备用
问题3:步骤(5)中要将沉淀进行洗涤,假如未经洗涤,则测定的碳酸钙纯度将 (偏高、偏低、无影响)。
综上所述,你认为4个方案中,最好的方案是 ,其它方案的缺点分别是:
方案IV:沉淀的洗涤、干燥、称量操作过程复杂,轻易造成较大误差;
方案 ; 。
方案 ; 。
四、(本题包括3小题,共33分)
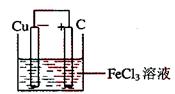
24.(12分) 铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应 ,负极反应 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
。
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH | |
|
Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
|
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式 、
劣质不锈钢腐蚀的实验现象: 25.(11分)I.高炉炼铁中发生的基本反应之一是FeO(s) CO(g)⇋Fe(s) CO2(g) ΔH>0。其平衡常数可表达为k =c(CO2)/c(CO),已知1100℃时,k=0.263。
(1)温度升高,平衡移动后达到新的平衡,高炉内CO2和CO的体积比值 (填“增大”“减小”或“不变”),平衡常数k值 (填“增大”“减小”或“不变”)。
 (2)1100℃时测得高炉中c(CO2)=0.025mol∙L-1,c(CO)=0.1mol∙L-1,在这种情况下,该反应是否处于平衡状态 (填“是”或“否”)。此时,化学反应速率是v(正) v(逆)(填“>”“<”或“=”),原
(2)1100℃时测得高炉中c(CO2)=0.025mol∙L-1,c(CO)=0.1mol∙L-1,在这种情况下,该反应是否处于平衡状态 (填“是”或“否”)。此时,化学反应速率是v(正) v(逆)(填“>”“<”或“=”),原
因是
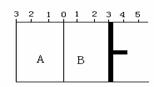
II.如图所示,温度不变时,把某容器分割成A、B两部分,A容器体积固定不变,B有可移动的活塞,现在A中充入2 mol SO2和1 mol O2,在B中充入2 mol SO3和 1 mol N2,在相同条件下发生可逆反应:2 SO2(g) O2(g) ![]() 2 SO3(g)。根据下列要求填写空白:
2 SO3(g)。根据下列要求填写空白:
(1)固定活塞位置在3处不动,达到平衡时,设A中压强为PA , B中压强为PB,则PA与PB的关系是PA _____ PB(填“<”、“=”、“>”)。
(2)若要使A与B中平衡状态相同,可移动活塞的位置应在 处。
(3)若活塞右移到5处,达到平衡后,B中SO3为x mol,
A中SO3为y mol , 则x和y 的关系是x y. (填“<”、“=”、“>”)
26. (10分)磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4—、HPO42—、和PO43—四种粒子形式存在,当溶液的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化。下图是H3PO4溶液中,各种粒子的物质的量分数δ随pH的变化曲线:
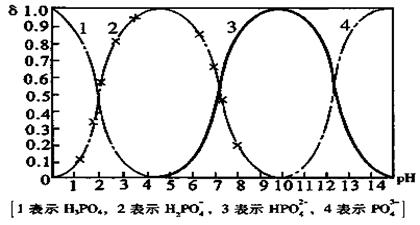
(1)设磷酸总浓度为c(总),写出c(总)与各粒子浓度间的关系式
。
(2)向Na3PO4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为 。当pH=7时,溶液中主要存在的阴离子(OH—离子除外)是 。
(3)从图中推断NaH2PO4溶液呈 性(填“酸”、“碱”、或“中”),其原因是
。
(4)在Na3PO4溶液中,c(Na )/ c(PO43—) 3(填“>”、“==”、或“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na )/ c(PO43—)的值减小,原因是 。
五、(本题包括1小题,8分)
27.(8分)元素周期表反映了元素性质的周期性变化规律。请根据短周期元素
氢化物
沸点/℃
A
1317
B
100
C
19.5
D
-33
E
-162
在周期表中的位置、结构和相关性质,回答下列问题:
⑴ 短周期元素中,原子最外层电子数的1/2和电子层数相等的元素有 (写元素符号)。
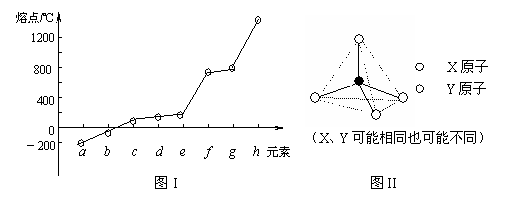
⑵ 第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如右表1所示,其中D的化学式为 ;第三周期元素单质的熔点(℃)变化如下图I 所示,其中h和b的元素符号为 。
|
图I |
|
图II |
|
0 |
|
800 |
|
-200 |
|
400 |
|
熔点/℃ 1200 |
|
a b c d e f g h 元素 |
|
X原子 |
|
Y原子 |
|
(X、Y可能相同也可能不同) |
 |
⑷ 第二、第三周期的某些元素中能形成具有图II所示的结构单元的单质和化合物:
其中熔点最高单质的名称是 ;同周期元素形成这种结构单元的化合物的化学式为: 。
六、选做题(本题包括2小题,每小题10分,考生只能选做一题。28小题为“有机化学基础”内容的试题,29题为“物质结构与性质”内容的试题)
考生注重:
28、29题为选做题,考生可任选一题。先在答题卡指定位置填写你所选择的试题号,再按要求答题,假如不填试题号,一律按0分计。28题适合选修《有机化学基础》模块的考生解答,29题适合选修《物质结构与性质》模块的考生解答。
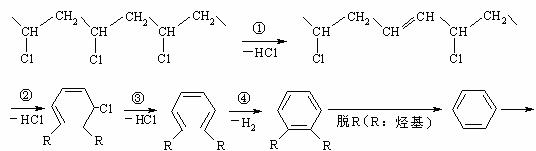
28.(共10分)研究表明,火灾中绝大多数人的第一死因并非高温烘烤或火烧,而是慌乱奔跑时吸入烟雾中毒。且起火的建筑装修越豪华,这一点越明显。聚氯乙烯是制作装修材料的最常用原料,失火时聚氯乙烯在不同的温度下,发生一系列复杂的化学变化,产生大量有害气体,其过程大体如下:
请回答下列问题:
(1) 火灾中由聚氯乙烯产生的有害气体,其化学成分主要是 ,你认为其中含量最大的为 ,在火灾现场,为防止气体中毒的防护措施是 ;
(2)工业上用乙烯和氯气为原料经下列各步合成PVC:
|
一定条件 ③ |

|
一定条件 ② |

|
一定条件 ① |
 乙烯 甲 乙 PVC
乙烯 甲 乙 PVC
乙是PVC的单体,其结构简式为 ,反应①、③的化学方程式分别为
、 。
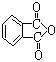
(3)聚氯乙烯可以制成保鲜膜,化学工作者十分关注聚氯乙烯(PVC)保鲜膜的安全问题。PVC保鲜膜的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标准的增塑剂DEHA。 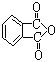 邻苯二甲酸辛酯(DOP)是国家标准中答应使用的增塑剂之一,邻苯二甲
邻苯二甲酸辛酯(DOP)是国家标准中答应使用的增塑剂之一,邻苯二甲
酸酐( ) 是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP(分子式
为C10H10O4),DMP属于芳香酸酯,写出制取DMP的反应方程式: 。
29.(10分)W、X、Y、Z四种元素的原子序数依次增大。其中Y原子的L电子层中,成对电子与未成对电子占据的轨道数相等,且无空轨道;X原子的L电子层中未成对电子数与Y相同,但还有空轨道;W、Z的原子序数相差10,且Z原子的第一电离能在同周期中最低。
(1)写出下列元素的元素符号:W ,X ,Y ,Z 。
(2)XY分子中,X原子与Y原子都达到8电子稳定结构,则XY分子中X和Y原子用于成键的电子数目分别是 ;根据电子云重叠方式的不同,分子里共价键的主要类型有 。
(3)XY2与ZYW反应时,通过控制反应物的物质的量之比,可以得到不同的产物,相同条件下,在水中溶解度较小的产物是 (写化学式),其原因是该化合物阴离子间可形成二聚离子或多聚链状离子。该化合物阴离子能够相互缔合的原因是:

|
请 在 密 封 线 内 作 答 |

|
班级 姓名 座号
|
 08届高三月考(3) 化学科考试答题卷
08届高三月考(3) 化学科考试答题卷
|
题 号 |
一、二 |
三 |
四 |
五 |
六 |
总 分 | ||||
|
1~20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
||
|
分 数 |
||||||||||
选择题答题区,用2B铅笔填涂。
第二部分非选择题(共80分)
以下为非选择题答题区,必须用黑色字迹的签字笔或钢笔在指定的区域作答,否则答案无效。
三、(本题包括3小题,共28分)
|
实验目的 |
瓶中加入的试剂 |
气体入口(填a或b) |
|
收集NO |
||
|
收集SO2 |
||
|
除去HBr中的Br2 |
21.
22.
I 课题名称:__________________________________________
V 实验讨论:(1) _________%
(2) ________ ______________
____________ _______________________。
VI 实验结论:________________________________________________
23.
[方案I]
[方案II] 问题1:
。
问题2:
[方案III]问题1: ;
问题2
。
[方案IV]问题1: 问题2
问题3:
方案 ; 。
方案 ; 。
四、(本题包括3小题,共35分)
24.(1) 。
(2)装置图
|
----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------- |
 正极反应:
正极反应:
负极反应:
(3)
(4)
25. Ⅰ(1)
(2)
原因是
II.
(1) PA _____ PB
(2) (3) x y.
26.
(1) 。
(2) 、
。
(3)
。
(4) 。
五、(本题包括1小题,8分)
27.⑴
⑵ ; 。
⑶ 。
⑷ ; 。
六、选做题(共10分)
你选做第 题
28.
(1) , ,
;
(2) ,
。
(3) 。
29.(1):W ,X ,Y ,Z 。
(2) 。
(3)
答案:
|
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
答案 |
B |
B |
D |
C |
D |
A |
A |
D |
D |
C |
|
题号 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
答案 |
BD |
B |
AC |
D |
CD |
B |
AC |
B |
B |
AB |
21.
|
实验目的 |
瓶中加入的试剂 |
气体入口(填a或b) |
|
收集NO |
水 |
b |
|
收集SO2 |
a | |
|
除去HBr中的Br2 |
CCl4(或苯、汽油) |
a |
|
|
V (1) 40.8 (2分)
(2)Cl2;湿润的碘化钾淀粉试纸;KClO3与Cr2O3 发生了氧化还原反应 (3分)
VI 氧化铁、氧化铜、二氧化锰等都可作为KClO3受热分解的催化剂(或氧化铁的催化能力和二氧化锰的催化能力较好)。其他合理也给分(2分)
23.(14分)方案Ⅰ:偏低(1分)
方案Ⅱ:①托盘天平(砝码)、药匙、酸式和碱式滴定管、锥形瓶(3分)
②B (1分)
方案Ⅲ: ①保证CaCO3完全分解 (1分)
②先在空气中适当冷却后再放进干燥器中冷却(1分)
方案Ⅳ:①A、B (2分) ②C (1分) ③偏高(1分) 方案Ⅱ(1分)
方案Ⅰ:气体体积难以准确测量(1分)
 方案Ⅲ:实验室难以提供1000℃的高温(1分)
方案Ⅲ:实验室难以提供1000℃的高温(1分)
24.(12分)(1)2Fe3 +Cu=2Fe2 +Cu2 (2分)
(2)装置图(2分)
正极反应:Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+)(1分)
负极反应:Cu=Cu2++2e-(或Cu-2e-=Cu2+)(1分)
(3)①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液的pH至3.2~4.7;
③过滤[除去Fe(OH)3] (3分)
(4)CuO+H2SO4=CuSO4+H2O(1分)
CuSO4+Fe=FeSO4+Cu(1分),不锈钢表面有紫红色物质生成。(1分)
25.(11分) I.(1)增大 增大 (2)否 > [CO2]/[CO]=0.25<0.263,故平衡向正反应方向移动,v(正) > v(逆)(以上每空1分)
II.(1)< (2) 3 (3) < (每空2分)
26、(10分)
(1)c(总)== c(H3PO4) c(H2PO4—) c(HPO42—) c(PO43—)(2分)
(2)HPO42— H == H2PO4—(1分) H2PO4—(1分)、HPO42—(1分)
(3)酸(1分)H2PO4—在溶液中的电离程度大于水解程度。(2分)
(4)>(1分),KOH抑制了PO43—的水解(1分)
24.(8分)(1)(1分) C S (2) (3分) NH3 Si、Cl
![]() (3) (1分)NH4+ H2O NH3·H2O H
(3) (1分)NH4+ H2O NH3·H2O H
(4)(3分)金刚石 CF4、SiCl4
六、(选做题,本题共10分)
28、(共10分)
(1)(共5分)HCl、 ![]() 、、CO(答3个得3分,答错1个倒扣1分,但不出现负分);HCl(1分);用湿毛巾捂口鼻,弯腰呼吸,快速逃离现场(1分)。
、、CO(答3个得3分,答错1个倒扣1分,但不出现负分);HCl(1分);用湿毛巾捂口鼻,弯腰呼吸,快速逃离现场(1分)。
(2)(共3分)CH2=CHCl(1分) ,CH2=CH2 Cl2 CH2Cl-CH2Cl(1分)
CH2Cl-CH2Cl ![]() CH2=CHCl HCl(1分)
CH2=CHCl HCl(1分)
![]() (3) 2 CH3OH
(3) 2 CH3OH ![]() H2O
H2O 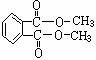 (2分)
(2分)
29、(共10分)
(1)H、C、O、Na(各1分,共4分)
(2)2和4(1分),σ键,π键
(3)NaHCO3(1分),因为HCO3—中含有O—H键,相互之间可通过O—H┅O氢键缔合(2分)
| |