| |
|
[组图]化学反应速率与化学平衡 (下)
|
| 查询化高三上末的详细结果
|
|
化学反应速率与化学平衡 (下)
教学内容
1.化学平衡图象的特征分析
2.化学平衡问题研究的重要思维方
3.有关转化率的判定计算
二、学习指导
  (一)化学平衡的图象问题研究 (一)化学平衡的图象问题研究
1. 作用:化学反应速率和化学平衡的有关理论具有一定的抽象性,.运用各种图象能直观地反映可逆反应的变化规律及特点,.能从定性和定量两方面来分析和研究变化的因素、方向和程度.
2.方法:
(1)注重纵坐标和横坐标所对应的物理量.,只要其中一个物理量改变,就可能导致图象的改变.
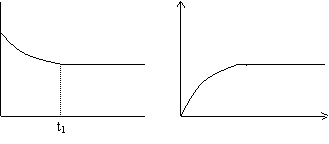
例如 对一可逆反应从起始到达平衡,某反应物的A的百分含量)、A的转化率aA分别对时间作图,曲线正好相反.
t1 t
A的百分含量与时间关系 A的转化率与时间关系
(2)弄清纵坐标和横坐标两种物理量之间的相互关系。.作图或析图时要注重变化的方向、趋势、程度,.如考虑是直线还是曲线?是上升还是下降?到一定时是否会不再改变?若是两条或两条以上的直线,斜率是否相同?若是两曲线,它们的曲率是否相等?……这一系列的问题必须思考清楚。.
(3)抓住要害的点:如原点、最高点、最低点、转折点(拐点)、交点等.。同样有一系列问题值得去好好思考,如该不该通过原点?有没有最高(或最低)点?为何有转折点、交点等?
3.图象类型
(1)横坐标——时间(t)
纵坐标——反应速率(v) 或某物质浓度(C)或某成分的百分含量(A%)
或某反应物的转化率(aA)
特点:
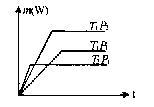
①可逆反应从非平衡到达平衡以前,v、C、A% 、aA均随时间(t)变化,到达平衡后,则不随时间而改变.。图象中一定将出现平行于横坐标的直线,简称“平台”.
②出现转折“平台”的先后取决于达到平衡所需要的时间.而时间的长短又取决于反应速率的大小.
温度(T)一定,压强(P)越大,V正、V逆越大,t越小
压强(P)一定,温度(T)越大,V正、V逆越大,t越小
T、P一定,使用正催化剂后V正、V逆均增大,t缩小.
③“平台”的相对高低,则由外界条件对平衡的影响来决定.“平台”越高,说明条件越有利于纵坐标对应物理量的提高.反之,则不利.
故可根据图象特点来分析可逆反应特点.
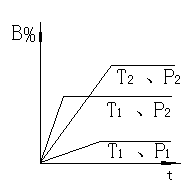
例1 已知某可逆反应mA(g)+nB(g) pC(g)+Q在密闭容器中进行反应,测得在不同时间t、温度T和压强P与反应物B在混合气中的百
分含量B%的关系曲线如图所示.
A.T1<T2,P1>P2,m+n>P,Q<0
B.T1> T2,P2>P1,m+n<P,Q<0
C.T2> T1,P2>P1,m+n<P,Q<0
D.T1> T2,P2>P1,m+n>P,Q>0
解析:①根据达到平衡的时间长短,可断定
T2<T1,P2>P1
②根据“平台”高低,可断定
低温有利于B%增大,说明逆反应是放热反应,即正反应为吸热,Q<0
高压有利.B%增大,说明增大压强,平衡逆移,故m+n<P.
由此可知,本题答案:B.
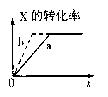
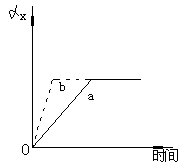       例2 如图所示,a曲线表示一定条件下可逆反 例2 如图所示,a曲线表示一定条件下可逆反
应:X(g)+Y(g) 2Z(g)+W(s)+Q的反应过程中X
的转化率和时间的关系.若使a曲线变为b曲线,可
采取的措施是 [ ]
A.加入催化剂 B.增大Y的浓度
C.降低温度 D.增大体系压强
解析:①达平衡所需时间b<a
正逆反应速率Vb >Va 
②改变条件后ax不变
平衡不移动
③该可逆反应ΔVg=0
可加催化剂或加压
答案:B、D.
在反应速率(v)-时间(t)图象中,在保持平衡的某时刻t1改变某一条件前后,V正、V逆的变化有两种:
V正、V逆同时突破——温度、压强、催化剂的影响
V正、V逆之一渐变——一种成分浓度的改变
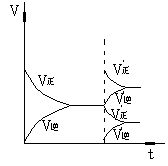 现图示如下: 现图示如下:
图 改变条件
增加反应物浓度
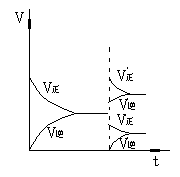
降低生成物浓度
升温或加压(Δng≠0)
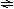 (5)在浓度C-时间t图象中 (5)在浓度C-时间t图象中
改变温度瞬间,各物浓度不变,故平衡虽破坏,但各物质的浓度变化均连续.
改变压强瞬间,各物质浓度(气体)均突变.加压——突增,减压——突减.
改变某一成分浓度时,该成分浓度突变,其它物质不变,故变化是连续的.
例 3. 可逆反应N2+3H2 2NH3+Q,从反应开始经t1秒达平衡状态,因条件改变,平衡在t2秒时发生移动,在t3秒时,又达到新的平衡状态.试根据t2-t3秒曲线判定,下列图1、图2所表示的平衡移动方向和变化条件各是什么?
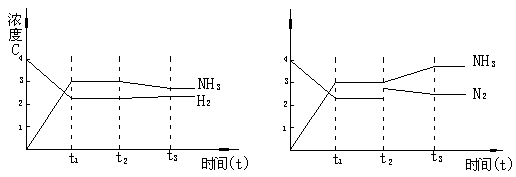
图1 图2
解析 图1中t2-t3曲线与原来连续变化,说明只可能改为变温度引起.NH3浓度下降,H2浓度增大,说明平衡是逆向移动,故变化的条件是升温.
图2中 ,t2时改变条件前后NH3的浓度连续变化,而N2浓度突变,说明只能是增加N2浓度引起,平衡正向移动.
例 5.气态反应A+B C+D,其它条件不变,在有催化剂条件(a)时和无催化剂条件(b)时的反应过程中,有关的量(纵坐标)随时间(横坐标)的变化情况错误的是[ ]
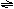 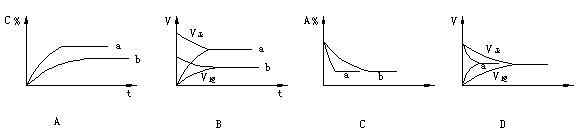
解析:使用催化剂,同等程度改变正逆反应速度,缩短达到平衡所需时间,但不改变平衡状态。故不论有无催化剂,达到平衡时同一成分的百分含量相同。所以选项A错C对。选项D中似乎达平衡所需时间长短合理,但使用催化剂,反应速率不但不增大,反而减小,显然不合理。选项B正确。本题正确选项:B、C
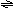 例6..2.右图为条件一定时,反应 例6..2.右图为条件一定时,反应
2NO+O2 2NO2+Q(Q>0)中NO的最大转
化率与温度变化关系曲线图,图中有A、B、C、D、
E五点,其中表示未达到平衡状态,且V正<V逆的
点是[ ]
 A.B和C B.A和E A.B和C B.A和E
C.E D.A和C
解析:当条件一定时,反应的最大转化率一定是达平衡状态时。该图像与初中所学的溶解度曲线很相似。A、D所在的曲线上所有的点均为平衡时的状
态。曲线上下的点均为非平衡时的状态。反应从非平衡自发达平衡。
从图中可看出,B、C所在状态的转化率小于该温度平衡时。说明反应正向正反应方向移动。
即V正>V逆。而E所在状态的转化率大于该温度平衡时的,说明反应正向逆反应方向移动。
即V正<V逆。故本题选C.。
(2)横标——温度T
纵标——百分含量A% 或转化率aA 或反应速率C
特点:①横坐标为T时,纵标对应的各物理量均随T变化而变化.
②若测得在不同温度下经过足够长时间达平衡时A%、αA、C均随T单调变化.
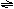 ③若测得在不同温度下经过同一时间在某一时刻测得A%、αA、C随T变化而可能呈现先上升→达最高点→ 下降的变化趋势 ③若测得在不同温度下经过同一时间在某一时刻测得A%、αA、C随T变化而可能呈现先上升→达最高点→ 下降的变化趋势
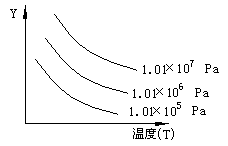 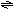 例7. 下图表示外界条件(温度、压力)的变化对下列反应的影响. 例7. 下图表示外界条件(温度、压力)的变化对下列反应的影响.
L(s)+G(g) 2R(g)-Q(吸热)
在图中Y轴是指
A.平衡混合气中R的质量分数
B.平衡混合气中G的体积分数
C.G的转化率
D.L的转化率
    解析 由图象可知:T↗,Y↓. G%↓,R%↗. 解析 由图象可知:T↗,Y↓. G%↓,R%↗.
由反应可知:T↗,平衡正移. 反应物α↗.
答案:B.
例5 在容积相同的五个密闭容器中分别放
入同量的A2和B2,在不同温度下同时任其发生
反应:A2(g)+3B2(g) 2AB3(g),分别在
某一同时刻测得其中AB3所占的体积分数变化
如图所示.下列说法不正确的是 [ ]
A.正反应是放热反应
B.E、F二点尚未达到平衡
C.H、I二点尚未达到平衡
D.G、H、I三点可能已达平衡状态
解析 随着温度的升高反应速率加快.从G到H、I,AB3%所占的体积分数降低,能得出正反应是放热反应;E、F两点AB3%比G点低,原因是低温下反应速率慢,反应未达平衡状态.选C.
 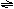 (二)解决化学平衡问题的重要思维方法 (二)解决化学平衡问题的重要思维方法
1.可逆反应“不为零”原则.
可逆性是化学平衡的前提,达到平衡时应是反应物和生成物共存的状态,每种物质的量不为零.
一般可用极限分析法推断. 即假设反应不可逆,则最多生成产物多少,有无反应物剩余,余多少.这样的极值点是不可能达到的,故可用确定某些范围或在范围中选择合适的量.
例3 在一定温度下将1 molCO和1mol水蒸气放在密闭容器中反应:CO+H2O CO2+H2,达平衡后测得CO2为0.6mol,再通入4mol水蒸气,达新平衡后CO2的物质的量可能是[ ]
A.0.6mol B.1mol C.0.8mol D.1.2mol
解析 加入H2O(g)平衡正移,n·CO2>0.6mol但不可能任意增大,根据“不为零”原则,1molCO即使完全反应也只可能生成1molCO2,所以0.6mol<nCO2<1mol.答案C合适.
2.“一边倒”原则
可逆反应,在条件相同时(等温等容),若达到等同平衡,其初始状态必须能互变,从极限角度看,就是各物质的物质的量要相当.因此可以采用一边倒的原则来处理以下问题:
(1)化学平衡等同条件(等温等容)
aA(g)+bB(g) cC(g)
①始 a b 0 平衡态Ⅰ
②始 0 0 c 平衡态Ⅱ
③始 x y z 平衡态Ⅲ
为了使平衡Ⅲ =Ⅱ=Ⅰ
根据“一边倒”原则,即可得
x+ 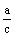 z=a z=a 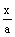 + + 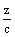 =1 =1
y+ 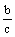 z=b z=b 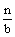 + + 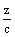 =1 =1
 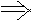  例8 温度、催化剂不变,向某一固定体积的密闭容器内按下列各组物质的量加入H2、N2、NH3,反应达平衡时;氨气浓度最大的一组是[ ] 例8 温度、催化剂不变,向某一固定体积的密闭容器内按下列各组物质的量加入H2、N2、NH3,反应达平衡时;氨气浓度最大的一组是[ ]
|
|
A |
B |
C |
D | |
H2 |
6 |
1 |
3.5 |
5 | |
N2 |
2 |
0 |
1 |
1.5 | |
NH3 |
0 |
4 |
2 |
1 | |
  解析 2NH3 N2+3H2.根据反应“一边倒”换算. 解析 2NH3 N2+3H2.根据反应“一边倒”换算.
B 0 2 6+1=7
C 0 2 3+3.5=6.5
D 0 2 1.5+5=6.5
由此可知,符合题意的是B.
3.“过渡态”方法.
思路:相同倍数增加各种反应物的浓度,相当于增大体系压强,根据平衡移动方向来确定转化率的变化情况.
例9. .一真空密闭容器中盛有1molPCl5,加热到200℃时发生反应.PCl5(g) PCl3(g)+Cl2(g),反应达到平衡时,PCl5所占体积百分数为M%.若在同一温度和同一容器中,最初投入的是2molPCl5 ,反应达平衡时,PCl5所占体积百分数为N%,则M和N的正确关系是[ ]
A.M>N B.M <N C.M=N D.无法比较
解析:从1molPCl5 到2molPCl5投料,相当于增大体系压强,对该可逆反应而言,促使平衡逆移,反应达平衡时,PCl5所占体积百分数增大,故选B.
巩固练习
(一)选择
1. 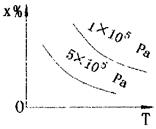 如右图所示表示平衡混合物中x的百分含量 如右图所示表示平衡混合物中x的百分含量
在不同的压强下,随湿度变化的情况,在下列平衡体
系中,x可以代表用下横线标明的物质(反应中各物
质为气态)的是( )
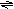 A.N2 2H2 2NH3△H<0 A.N2 2H2 2NH3△H<0
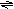 B.H2 I2 2HI △H<0 B.H2 I2 2HI △H<0
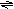 C.2SO3 2SO2 O2△H>0 C.2SO3 2SO2 O2△H>0
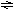 D.4NH3 5O2 4NO 6H2O△H<0 D.4NH3 5O2 4NO 6H2O△H<0
2. 在溶积固定的4L密闭容顺中,进行可逆反应:
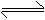 X(气) 2Y(气) 2Z(气)并达到平衡,在此过 X(气) 2Y(气) 2Z(气)并达到平衡,在此过
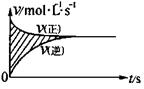 程中,以Y的浓度改变表示的反应速率υ(正)、υ(逆) 程中,以Y的浓度改变表示的反应速率υ(正)、υ(逆)
与时间t的关系如右图,如图中阴影部分面积表示( )
A.X的浓度的减少 B.Y的物质的量的减少
C.Z的浓度的增加 D.X的物质的量的减少
3.今有反应X(g) Y(g) 2Z(g) △H<0若反应
开始经t1秒后达到平衡,又经t2秒后,由于反应条件的
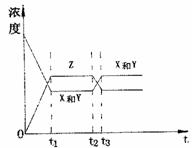 改变使平衡破坏,则t3时又达到平衡,如图表示,试分 改变使平衡破坏,则t3时又达到平衡,如图表示,试分
析,以t2到t3秒曲线变化的原因因是( )
A.增大了X和Y的浓度
B.使用了催化剂
C.增加了反就体系的压强
D.升高了反应的湿度
 4.可逆反应N2O5 N2O4 4.可逆反应N2O5 N2O4 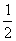 O2△H<0在t1时达到 O2△H<0在t1时达到
平衡,然后在t2时开始加热,至一定湿度后停止加热并
增温,到t3时又建立平衡,下列各图解表示上述情况的是( )
A B C D
 5.可逆反应aX(气) bY(气) cZ(气) dW(气) △H=Q 5.可逆反应aX(气) bY(气) cZ(气) dW(气) △H=Q
 在压强P1、P2湿度T1、T2下,产物W 的质量与反应时间 在压强P1、P2湿度T1、T2下,产物W 的质量与反应时间
t的关系如图。下列各项正确的是( )
A.P1>P2
B.Q<0
C.T1>T2
D.c d>a b
6.都符合两个图象的反应是(C%表法反应物质量分数,v表示速率,P表示压强,t表示时间)( )
(1) (2)
 A.N2O3(g) NO2(g) NO(g) △H<0 A.N2O3(g) NO2(g) NO(g) △H<0
 B.2NO2(g) H2O(1) 2HNO3(1) NO(g) △H<0 B.2NO2(g) H2O(1) 2HNO3(1) NO(g) △H<0
 C.4NH3(g) 5O2(g) 4NO(g) 6H2O(g) △H<0 C.4NH3(g) 5O2(g) 4NO(g) 6H2O(g) △H<0
 D.CO2(g) C(s) 2CO(g) △H>0 D.CO2(g) C(s) 2CO(g) △H>0
 7.对于反应A(气) 2B(气) 2C(气) △H<0,下面各图能正确反映在这一反应中,反应时间t,湿度T与平衡混合物中C的百分含量关系的是( ) 7.对于反应A(气) 2B(气) 2C(气) △H<0,下面各图能正确反映在这一反应中,反应时间t,湿度T与平衡混合物中C的百分含量关系的是( )
A B C D
 8.在密闭容器中发生反应2SO2 O2 2SO2(气),起始时SO2和O2分别为20mol和10mol,达到平衡时,SO2的转化率为80%,若从SO3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为( ) 8.在密闭容器中发生反应2SO2 O2 2SO2(气),起始时SO2和O2分别为20mol和10mol,达到平衡时,SO2的转化率为80%,若从SO3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为( )
 A.10mol和10% B.20mol和20% A.10mol和10% B.20mol和20%
C.20mol和40% D.30mol和80%
9.右图中,a曲线表示一定条件下可逆反应X(g)
 Y(g) 2Z(g) W(s) Q的反应过程,若使a曲线变 Y(g) 2Z(g) W(s) Q的反应过程,若使a曲线变
为b曲线,可采取的措施是( )
A.降低湿度 B.增大Y的浓度
C.加入催化剂 D.增大体系压强
 10.在密闭容器中发生反应:aX(气) bY(气) cZ(气) dW(气),反应达到平衡后,保持湿度不变,将气体压缩到原来的 10.在密闭容器中发生反应:aX(气) bY(气) cZ(气) dW(气),反应达到平衡后,保持湿度不变,将气体压缩到原来的 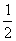 体积,当再次达到平衡时,W的浓度为原平衡的1.8倍,下列叙述中不正确的是( ) 体积,当再次达到平衡时,W的浓度为原平衡的1.8倍,下列叙述中不正确的是( )
A.平衡向逆反应方向移动 B.a b<c d
C.Z的体积分数增加 D.X的转化率下降
 11.在等温、等容条件下有下列气体反应:2A(g) 2B(g) C(g) 3D(g)。现分别从两条途径建立平衡:Ⅰ.A和B的起始浓度均为2mol·L—1;Ⅱ.C和D的起始浓度分别为2mol·L—1和6mol·L—1.下列叙述正确的是( ) 11.在等温、等容条件下有下列气体反应:2A(g) 2B(g) C(g) 3D(g)。现分别从两条途径建立平衡:Ⅰ.A和B的起始浓度均为2mol·L—1;Ⅱ.C和D的起始浓度分别为2mol·L—1和6mol·L—1.下列叙述正确的是( )
A.Ⅰ和Ⅱ两途径最终达到平衡时,体系内混合气体的体积分数相同
B.Ⅰ和Ⅱ两途径最终达到平衡时,Ⅰ中A的转化率与Ⅱ中B的产率之和不为1
C.达到平衡时,Ⅰ途径的反应速率υ(A)等于Ⅱ途径的反应速率υ(A)
D.达平衡时,第Ⅰ条途径混合气体的密度为第Ⅱ条途径混合气体密度的1/2
 12.对于可逆反应:A2(g) 3B2(g) 2AB3(g) Q(Q>0),下列图像中正确的是( ) 12.对于可逆反应:A2(g) 3B2(g) 2AB3(g) Q(Q>0),下列图像中正确的是( )
(二)填空
13.在一固定容积的密闭容器中,1molHI  气体建立如下平衡2HI H2(g) I2(g),此时 气体建立如下平衡2HI H2(g) I2(g),此时
HI的转化率为25%,其它条件不变时再充入1molHI的气体,重新平衡后HI的转化率为
( )23%(填“>”“<”或“=”=
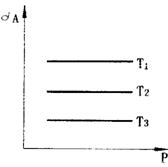  14.对于吸热反应A(g) B(g) C(g) D(g) A的转化率与压强(P)和湿度(T)的关系如 14.对于吸热反应A(g) B(g) C(g) D(g) A的转化率与压强(P)和湿度(T)的关系如
图所示则T1、T2、T3的关系是___________.
 15.在一定条件下,可逆反应A B Mc的变化如右图所示,已知坐标表示在不同湿度和 15.在一定条件下,可逆反应A B Mc的变化如右图所示,已知坐标表示在不同湿度和
压强下生成物C在混合物中的质量分数,p为反应在T2的湿度时达到平衡后向容器加压的变化
情况,问:
(1)湿度T1_________T2(填<、>或==.
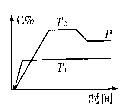 (2)正反应是_______反应(填吸热或和热). (2)正反应是_______反应(填吸热或和热).
(3)假如A、B、C均为气体,则m_______
2(填<、>或==
(4)当湿度和容积不变时,如在平衡体系中
加入一定量的某稀有气体,则体生活费的压强
_________,平衡______移动.
 16.可逆反应2A(g) B(g) nC(g)△H=Q,图甲为同温度不同压强时,混合气体中A的体积分数A%随反应时间变化的曲线;图乙为同一压强不同湿度时,混合气体中A的体积分数A%随反应时间变化的曲线试根据曲线确定 16.可逆反应2A(g) B(g) nC(g)△H=Q,图甲为同温度不同压强时,混合气体中A的体积分数A%随反应时间变化的曲线;图乙为同一压强不同湿度时,混合气体中A的体积分数A%随反应时间变化的曲线试根据曲线确定
甲 乙
(1)P1与P2关系___________,n______3(填<、>或==
(2)T1与T2的关系是____________,Q______0(填<、>或==
 17.某化学反应2A B D在四种不同条件下进行,B、D起始浓度为见反应物A的浓度(mol/L)B随反应时间(min)的变化情况如下表: 17.某化学反应2A B D在四种不同条件下进行,B、D起始浓度为见反应物A的浓度(mol/L)B随反应时间(min)的变化情况如下表:
|
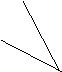 实验 实验
序号 |
时
浓 间
度
湿度 |
0 |
10 |
20 |
30 |
40 |
50 |
60 | |
1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 | |
2 |
800℃ |
C2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 | |
3 |
800℃ |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 | |
4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 | | 
 17.(1)0.013 (2)1.0 ,催化剂
17.(1)0.013 (2)1.0 ,催化剂![]()