| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
请依据表中数据判定: (1)__________金属可能是最强的还原剂;__________金属一定不能从硫酸铜溶液中置换出铜。 (2)若滤纸不用盐溶液浸润而改用NaOH溶液浸润,则在滤纸上看到析出蓝色沉淀的是_________________(填字母)金属。其对应的原电池的电极反应式为:负极________,正极_____________。 20、已知B、C、D、K都是气体单质,物质A的焰色呈黄色,I为4核10电子中性分子,各有关物质之间的相互反应转化关系如下图所示,反应①--⑤ 都是用于工业生产的反应。
 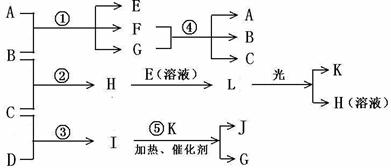
请填写下列空白: (1)写出下列物质的化学式:B ,J 。 (2)写出下列反应的离子反应方程式: H E(溶液)→L ; F G →A B C 。 (3)若I与E以物质的量比1:2反应,得到F、G和二元素六核化合物M,则M的电子式是 。 (4) 反应④用于工业生产时目前采用如图示装置,该装置的优点有: ① ; ② 。 (5) 如图示装置(溶液体积为100mL), 其阴极的电极方程式是 , 标况下,当电极上产生112mL B气体时(假设气体完全逸出,溶液体积不变),烧杯中溶液的pH= 。 21、反应①②是重要的化工反应,D、E、F、G为单质,D、E、G、H为气体,且只有E为有色气 体,F是常见的金属单质,G是空气中主要成分之一,K是白色胶状沉淀,C的焰色反应为黄色,其物质间的转化关系如下,虚框内是需设计的内容,反应物只能用A~J中的物质: (1)A的电子式 , H的结构式是 ; (2)A溶液的电解方程式是 ; C B→J的离子方程式是 ;
 (3)请设计F→K的最佳途径 (3)请设计F→K的最佳途径
(4)按设计得到1mol K,电解B时转移的电子数目是 ,至少需要另加试剂的物质的量是 : mol, : mol, : mol(可不填满)。 22、目前世界上比较先进的电解制碱术是离子交换膜法。试回答下列问题: (1)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2 、Mg2 、Fe3 、SO42-杂质,不符合电解要求,因此必须经过精制。 除去SO42-可用钡试剂,该钡试剂可以是 。(选填a、b、c) a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2 (2)现有200mL食盐水,其中含有少量的NaOH,该溶液的pH等于10,用石墨电极电解,当阴极产生的气体体积为0.224L(标准状况)时停止电解。 阳极的电极反应式为 。 电解后溶液的pH约为(忽略溶液的体积变化) 。 参考答案: 一、1、A 2 B 3 B 4 D 5 D 6 B 7 D 二、8 A 9 AD 10AC 11C 12 D 13 BC 14 B 15 CD 16 D 17 C 三、18、(1)2Fe3 +Cu=2Fe2 +Cu2
正极反应:Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+) 负极反应:Cu=Cu2++2e-(或Cu-2e-=Cu2+) (3)①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液的pH至3.2~4.7; ③过滤[除去Fe(OH)3] (4)CuO+H2SO4=CuSO4+H2O CuSO4+Fe=FeSO4+Cu,不锈钢表面有紫红色物质生成。 19、 ①因构成两电极的金属活泼性相差越大,电压表读数越大,根据提供的数据和电子的流动方向,各金属的活泼性顺序:C>A>D>Cu>B。 ②若用NaOH溶液作电解质,在滤纸上能看到有蓝色沉淀析出,则必须是Cu作该原电池的负极,即B组符合。 答案为:(1)C B (2)B 2Cu-4e-==2Cu2 2H2O O2 4e-==4OH- 20、1)Cl2、NO (2)H ClO-=HClO 2Cl- 2H2O = 2OH- H2↑ Cl2↑
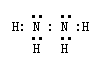 (3) (3)
(4) ①氢气与氯气不混合,减小了危险性 ②可得到纯净NaOH溶液。 (5) 2H2O 2e-=H2↑ 2OH-, 13。 21、(1) (2) 2NaCl 2H2O=2NaOH Cl2↑ H2↑、Al2O3 2OH—=2AlO2— H2O
 (3) (3)
(4)1.8×1024,HCl 0.25mol,NaOH 0.75mol 22、1)a c (2分) (2)2Cl- - 2e- = Cl2↑(2分) 13 (3分 参考答案: 一、1、A 2 B 3 B 4 D 5 D 6 B 7 D 二、8 A 9 AD 10AC 11C 12 D 13 BC 14 B 15 CD 16 D 17 C 三、18、(1)2Fe3 +Cu=2Fe2 +Cu2
正极反应:Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+) 负极反应:Cu=Cu2++2e-(或Cu-2e-=Cu2+) (3)①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液的pH至3.2~4.7; ③过滤[除去Fe(OH)3] (4)CuO+H2SO4=CuSO4+H2O CuSO4+Fe=FeSO4+Cu,不锈钢表面有紫红色物质生成。 19、 ①因构成两电极的金属活泼性相差越大,电压表读数越大,根据提供的数据和电子的流动方向,各金属的活泼性顺序:C>A>D>Cu>B。 ②若用NaOH溶液作电解质,在滤纸上能看到有蓝色沉淀析出,则必须是Cu作该原电池的负极,即B组符合。 答案为:(1)C B (2)B 2Cu-4e-==2Cu2 2H2O O2 4e-==4OH- 20、1)Cl2、NO (2)H ClO-=HClO 2Cl- 2H2O = 2OH- H2↑ Cl2↑
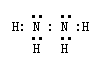 (3) (3)
(4) ①氢气与氯气不混合,减小了危险性 ②可得到纯净NaOH溶液。 (5) 2H2O 2e-=H2↑ 2OH-, 13。 21、(1) (2) 2NaCl 2H2O=2NaOH Cl2↑ H2↑、Al2O3 2OH—=2AlO2— H2O
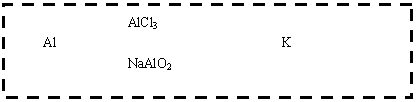 (3) (3)
(4)1.8×1024,HCl 0.25mol,NaOH 0.75mol 22、1)a c (2分) (2)2Cl- - 2e- = Cl2↑(2分) 13 (3分 参考答案: 一、1、A 2 B 3 B 4 D 5 D 6 B 7 D 二、8 A 9 AD 10AC 11C 12 D 13 BC 14 B 15 CD 16 D 17 C 三、18、(1)2Fe3 +Cu=2Fe2 +Cu2
正极反应:Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+) 负极反应:Cu=Cu2++2e-(或Cu-2e-=Cu2+) (3)①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液的pH至3.2~4.7; ③过滤[除去Fe(OH)3] (4)CuO+H2SO4=CuSO4+H2O CuSO4+Fe=FeSO4+Cu,不锈钢表面有紫红色物质生成。 19、 ①因构成两电极的金属活泼性相差越大,电压表读数越大,根据提供的数据和电子的流动方向,各金属的活泼性顺序:C>A>D>Cu>B。 ②若用NaOH溶液作电解质,在滤纸上能看到有蓝色沉淀析出,则必须是Cu作该原电池的负极,即B组符合。 答案为:(1)C B (2)B 2Cu-4e-==2Cu2 2H2O O2 4e-==4OH- 20、1)Cl2、NO (2)H ClO-=HClO 2Cl- 2H2O = 2OH- H2↑ Cl2↑
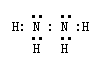 (3) (3)
(4) ①氢气与氯气不混合,减小了危险性 ②可得到纯净NaOH溶液。 (5) 2H2O 2e-=H2↑ 2OH-, 13。 21、(1) (2) 2NaCl 2H2O=2NaOH Cl2↑ H2↑、Al2O3 2OH—=2AlO2— H2O
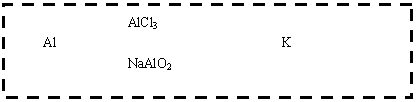 (3) (3)
(4)1.8×1024,HCl 0.25mol,NaOH 0.75mol 22、1)a c (2分) (2)2Cl- - 2e- = Cl2↑(2分) 13 (3分 参考答案: 一、1、A 2 B 3 B 4 D 5 D 6 B 7 D 二、8 A 9 AD 10AC 11C 12 D 13 BC 14 B 15 CD 16 D 17 C 三、18、(1)2Fe3 +Cu=2Fe2 +Cu2
正极反应:Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+) 负极反应:Cu=Cu2++2e-(或Cu-2e-=Cu2+) (3)①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液的pH至3.2~4.7; ③过滤[除去Fe(OH)3] (4)CuO+H2SO4=CuSO4+H2O CuSO4+Fe=FeSO4+Cu,不锈钢表面有紫红色物质生成。 19、 ①因构成两电极的金属活泼性相差越大,电压表读数越大,根据提供的数据和电子的流动方向,各金属的活泼性顺序:C>A>D>Cu>B。 ②若用NaOH溶液作电解质,在滤纸上能看到有蓝色沉淀析出,则必须是Cu作该原电池的负极,即B组符合。 答案为:(1)C B (2)B 2Cu-4e-==2Cu2 2H2O O2 4e-==4OH- 20、1)Cl2、NO (2)H ClO-=HClO 2Cl- 2H2O = 2OH- H2↑ Cl2↑
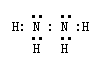 (3) (3)
(4) ①氢气与氯气不混合,减小了危险性 ②可得到纯净NaOH溶液。 (5) 2H2O 2e-=H2↑ 2OH-, 13。 21、(1) (2) 2NaCl 2H2O=2NaOH Cl2↑ H2↑、Al2O3 2OH—=2AlO2— H2O
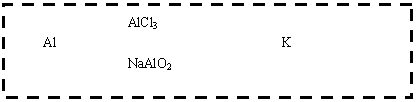 (3) (3)
(4)1.8×1024,HCl 0.25mol,NaOH 0.75mol 22、1)a c (2分) (2)2Cl- - 2e- = Cl2↑(2分) 13 (3分 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |