Ⅰ卷(共48分)
可能用到的相对原子质量:H:1 C:12 O:16 N:14 Cl:35.5 Na:23 Cu:64
一、 选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
1.下列解释不科学的是
A.“水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用生成了可溶性的Ca(HCO3)2的缘故。
B.长期盛放NaOH溶液的滴瓶不易打开,是因为NaOH与瓶中的CO2反应导致瓶内气
体减少形成“负压”的缘故。
C.严格地讲,“通风橱”是一种不负责任的防污染手段,因为实验产生的有害气体没有得到转化或吸收。
D.“雨后彩虹”、“海市蜃楼,’既是一种自然现象又是光学现象,也与胶体的知识有关。
2.正电子、负电子等都属于反粒子,它们跟普通电子、质子的质量、电量均相等,电性相反。科学家设想在宇宙的某些部分可能存在完全由反粒子构成的物质----反物质。1997年年初和年底,欧洲和美国的科研机构先后公布:他们分别制造出9个和7个反氢原子,这是人类探索反物质的一大进步。你推测反氢原子的结构是:
A.由1 个带正电荷的质子与一个带负电荷的电子构成
B.由1 个带负电荷的质子与一个带正电荷的电子构成
C.由1 个不带电的中子与一个带负电荷的电子构成
D.由1 个带负电荷的质子与一个带负电荷的电子构成
3.下列叙述不正确的是
A.硝酸银溶液通常保存在棕色的试剂瓶中,是因为硝酸银见光易分解
B.乙醇的沸点比甲醚(CH3OCH3)高,主要原因是乙醇分子间能形成氢键
C.反应AgCl+NaBr=AgBr+NaCl能在水溶液中进行,因为AgBr比AgCl更难溶于水
D. 常温下浓硫酸可贮存于铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应
4.《Inorganic Syntheses》(无机合成)一书中,有一如下图所示的装置,用以制备某种干燥的纯净气体。该装置中所装的药品正确的是
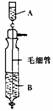 A.A中装浓硫酸,B中装浓盐酸
A.A中装浓硫酸,B中装浓盐酸
B.A中装浓盐酸,B中装浓硫酸
c.A中装氢氧化钠浓溶液,B中装浓氨水
D.A中装浓氨水,B中装氢氧化钠浓溶液
5.设NA代表阿伏加德罗常数,下列说法中正确的是
①常温常压下,17g甲基(一CH3)所含的中子数为9NA
②常温常压下,22.4LNO气体的分子数小于NA
③64g铜发生氧化还原反应,一定失去2NA个电子
④常温常压下,100mL0.5mol/L的乙酸溶液中,乙酸的分子数目小于0.05NA
⑤标准状况下,22.4L二氯甲烷所含有的分子数为4NA
⑥常温常压下,lmol氦气含有的核外电子数为4NA
A.①② B.③④ C.②④ D.⑤⑥
6.下列各组离子中,在溶液中能够大量共存的一组是
A.A1O2—、SO42—、Cl—、K B.Al3+、Ca2+、HCO3—、Na
C.Fe3+、NH4+、SO42—、SCN— D. H 、C1—、Na+、H PO42—
7.往一体积不变的密闭容器中充入H2和I2,发生反应H2(g) I2(g) ![]() 2HI(g);△H>O,当达到平衡后,t0时改变反应的某一条件(混合气体物质的量不变),且造成容器内压强增大,下列说法正确的是
2HI(g);△H>O,当达到平衡后,t0时改变反应的某一条件(混合气体物质的量不变),且造成容器内压强增大,下列说法正确的是
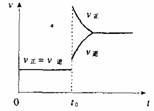 A.容器内气体颜色变深,平均分子量不变
A.容器内气体颜色变深,平均分子量不变
B.平衡不移动,混合气体密度增大
C.H2转化率增大,HI平衡浓度变小
D.改变条件前后,速度图象为(如右图)
8.有下列四组物质,假如把某组物质中的后者逐滴加入到前者中至过量,将出现“先产生白色沉淀,后白色沉淀溶解”的现象,这组物质是
A. 稀硫酸、氯化钡溶液 B. 硫酸亚铁溶液、氢氧化钠溶液
C. 氯化钠溶液、硝酸银溶液 D. 氯化铝溶液、氢氧化钠溶液
二、选择题(本题包括8小题,每小题3分,共24分。每小题有一个或两个选项符合题意。若正确答案只有一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9.为了探索月球上是否有生命存在的痕迹,就要分析月球岩石中是否包藏有碳氢化合物(当然这仅仅是探索的第一步)。科学家用氘盐酸(DCl)和重水(D2O)溶液处理月球岩石样品,对收集的气体加以分析,结果只发现有一些气体状态的碳氘化合物。这个实验不能用普通盐酸,其理由是
A.普通盐酸的酸性太强
B.普通盐酸具有挥发性
C.普通盐酸和月球岩石中的碳化物无法反应
D.无法区别岩石中原来含有的是碳化物,还是碳氢化合物
10.下列离子方程式正确的是
A.氢氧化钡溶液中加入过量小苏打 Ba2 2OH- 2HCO-3 = BaCO3↓ CO32- 2H2O
![]() B.用碳棒作电极电解氯化钠饱和溶液2Cl- 2H2O Cl2↑ H2↑ 2OH-
B.用碳棒作电极电解氯化钠饱和溶液2Cl- 2H2O Cl2↑ H2↑ 2OH-
C.氯气通入水中 Cl2 H2O = 2H Cl- ClO-
D.向漂白粉溶液中通人SO2气体:Ca2 2C1O— SO2 =CaSO3↓ 2H C1O
11.由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2在酸性条件下可以产生Cl2。下列关于混盐CaOCl2的有关判定正确的是
A.该混盐与硫酸反应产生1 molCl2时转移2NA个电子
B.该混盐的水溶液呈碱性
C.该盐也是一种复盐
D.该混盐中的氯元素的化合价为 1和—1
12.常温下,测得0.100mol/L。的某一元酸(HA)的pH不等于1,0.100mol/L的某一元碱(BOH)溶液中 ![]() 将该两种溶液等体积混合,所得溶液中离子浓度关系正确的是
将该两种溶液等体积混合,所得溶液中离子浓度关系正确的是
A.C(A— )>C(B )>C(H )>C(OH— ) B.C(B ) > C(A— ) > C(OH— ) > C(H )
C.C(B )>C(A—)> C(H ) > C(OH— ) D.C(A— ) > C(B )> C(H )=C(OH— )
13.某二价金属碳酸盐和碳酸氢盐的混合物跟足量盐酸反应,消耗H 和产生CO2的物质的量之比为6:5,该混合物中碳酸盐和碳酸氢盐的物质的量之比为
A.1:1 B.1:2 C.1:3 D.1:4
14.已知:CH3CH2CH2CH3(g)+6.5O2(g) ![]() 4CO2(g)+5H2O(l);DH =-2878 kJ/moL
4CO2(g)+5H2O(l);DH =-2878 kJ/moL
(CH3)2CHCH3(g)+6.5O2(g) ![]() 4CO2(g)+5H2O(l);DH=-2869 kJ/moL
4CO2(g)+5H2O(l);DH=-2869 kJ/moL
下列说法正确的是
A.正丁烷分子储存的能量大于异丁烷分子
B.正丁烷的稳定性大于异丁烷
C.异丁烷转化为正丁烷的过程是一个放热过程
D.异丁烷分子中的碳氢键比正丁烷的多
15.分别配制H3PO4、KOH的乙醇溶液,取10mLH3PO4的乙醇溶液在不断振荡下,滴加KOH溶液,立即产生白色沉淀,并不断增多,继而又逐渐减少至消失,然后又逐渐增多至一定量不再消失,以上事实说明
A.K2HPO4不溶于无水乙醇 B.KH2PO4、K3PO4不溶于无水乙醇
C.KH2PO4、K2HPO4不溶于无水乙醇 D.K2HPO4溶于无水乙醇
16.某白色固体可能由①NH4C1、②AlCl3、③NaCl、④AgNO3、⑤KOH中的一种或几种组成,此固体投入水中得澄清溶液,该溶液可使酚酞变红,若向溶液中加稀硝酸至过量,有白色沉淀产生。则对原固体判定不正确的是
A.肯定存在① B.至少存在②和⑤
C.无法确定是否有③ D.至少存在①④⑤
Ⅱ卷(共72分)
三、填空题(共52分)
17.(6分)下列实验操作或对实验事实的叙述错误的是 __________________(填序号)
①用稀硝酸清洗做过银镜反应实验的试管;
②加热坩埚中的硫酸铜晶体,失水后须在干燥器中冷却,再称量
③用碱式滴定管量取20.00 mL 0.1000 mol / L KMnO4溶液;
④用托盘天平称取10.50 g干燥的NaCl固体;
⑤不慎将苯酚溶液沾到皮肤上,立即用酒精清洗;
⑥玻璃棒蘸取溶液滴到放在表面皿上的pH试纸上,测得某碱溶液的PH值为12.7
⑦用10ml量筒量取7.50ml稀盐酸
= 8 \* GB3 ⑧用米汤检验含碘盐中的碘酸钾(KIO3)
= 9 \* GB3 ⑨用食用碱(Na2CO3)溶液洗涤餐具上的油污
= 10 \* GB3 ⑩配制氯化铁溶液时,将一定量氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度
18.(14分)某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
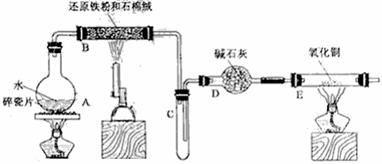
(1)装置B中发生反应的化学方程式是 。
(2)装置E中的现象是 。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3 的操作方法:
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
滤液→FeCl3溶液→FeCl3·6H2O晶体
① 步骤I中通入Cl2的作用是 。
② 步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:
。
③ 该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)
。
19.(4分)将4g甲烷和适量氧气混合后通入密闭容器中,点燃使之恰好完全反应,待恢复到原温度后,测得反应前后压强分别为3.03×105Pa和1.0l×105Pa,同时测得反应共放出222.5KJ热量。试根据上述实验数据,写出该反应的热化学方程式: 。
20.(14分)右图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,常温下为气体。J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出)请按要求回答:
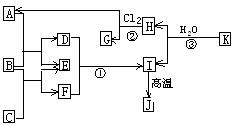 (1)写出B的化学式__________________,
(1)写出B的化学式__________________,
G的电子式______________________。
(2)反应①的离子方程式_________ ____。
(3)反应②的反应类型是_________,进行的条件是__________、____________。
(4)反应③的化学方程式为____________________________________。
21.(14分)已知某溶液中只存在OH-、H 、NH4 、Cl-四种离子,该溶液中各离子浓度的大小关系可能有下列4种情况:
①c(Cl-)>c(H )>c(NH4 )>c(OH-) ②c(Cl-)>c(NH4 )>c(H )>c(OH-)
③c(NH4 )>c(Cl-)>c(OH-)>c(H ) ④c(H ) c (NH4 )=c(OH-) c(Cl-)
请填写下列空白:
(1)若该溶液中只溶解了一种溶质,则该溶质是________,此时上述关系中,能表示该溶液中4种离子浓度关系的有_____ ___(填序号),用惰性电极电解该饱和溶液的化学方程式是_____ ___ ____ _;
(2)试再写出一个表示该溶液中离子浓度大小的关系式:____ _(与题目中提供的关系式不能重复)。则此时该溶液中的溶质是____ ____。若该溶液是体积相等的稀盐酸和氨水混合而成,且混合后pH=7,则混合前c(HCl)____ __c(NH3)(填“>”、“=”或“<”,下同),混合前盐酸中c(H )和氨水中c(OH-)的关系为c(H )__ __c(OH-)。
四、计算题(共20分)
22.(8分)环境监测测定水中溶解氧的方法是:①量取a mL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液,立即塞好瓶塞,反复顛倒振荡,使之充分反应。其反应式为:2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)。②测定:开塞后迅速加入1~2mL浓硫酸(提供H+)使之生成I2,有关反应式为MnO(OH)2+2I-+4H+=Mn2++I2+3H2O,再用b mol·L-1的Na2S2O3溶液滴定(以淀粉为指示剂),消耗了VmL溶液,滴定中S2O32-离子变成了S4O62-离子。试写出水中溶解氧的计算式(以g·L-1为单位)。
23.(12分)将一定质量、密度为1.11g·cm-3的食盐水用石墨电极进行电解,一段时间后停止通电,测得剩余溶液中溶质的质量分数为22.5%。若向剩余溶液中加入18g溶质质量分数为36.5%的盐酸,能使溶液恢复为电解前的组成。
(1)写出电解过程中发生的两个反应的化学方程式。
(2)计算电解过程中电路中通过的电子的物质的量。
(3)计算电解前食盐水的物质的量浓度。
模拟卷(三)参考答案
1.B 2.B 3.D 4.B 5.C 6.A 7.D 8.D
9.D 10.AB 11.BD 12.B 13.B 14.A 15.BD 16.B
17. = 3 \* GB3 ③ = 4 \* GB3 ④ = 6 \* GB3 ⑥ = 7 \* GB3 ⑦ = 8 \* GB3 ⑧
18.(1) 3Fe+4H2O(g) Fe3O4+4H2![]()
(2)黑色固体变红,右端管壁有水珠
(3)取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色
(4)① 将Fe2 氧化成Fe3 ;
② 加热浓缩。冷却结晶,过滤;
= 3 \* GB3 ③Fe3 3H2O ![]() Fe(OH)3 3H ,保持过量盐酸抑制Fe3 水解
Fe(OH)3 3H ,保持过量盐酸抑制Fe3 水解
19.CH4(g) 2O2(g)®CO2(g) 2H2O(l); DH=-890KJ/moL
20.(1)Al; CCl4电子式略
(2)Al3 +3AlO2—+6H2O=4Al(OH)3↓
(3)光照; 过量Cl2
(4)Al4C3+12H2O=4Al(OH)3+3CH4↑
![]() 21.(1)NH4Cl; = 2 \* GB3 ②;2NH4Cl 2NH3↑ H2↑ Cl2↑
21.(1)NH4Cl; = 2 \* GB3 ②;2NH4Cl 2NH3↑ H2↑ Cl2↑
(2)c(NH4 )>c(OH-)>c(Cl-)>c(H )
< ; >
![]()
![]() 22.则溶解氧的计算式为:
22.则溶解氧的计算式为: ![]()
23.(1)2NaCl 2H2O Cl2↑ H2↑ 2NaOH 2H2O O2↑ 2 H2↑
(2)1.45moL (3)4moL/L
