| 中文域名: 古今中外.com
英文域名:www.1-123.com 丰富实用的教育教学资料 |
| |
| |
| |
|
|
20.灰锡(以粉末状存在)和白锡是锡的两种同素异形体。 已知:①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g);DH1 ②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g);DH2 ③Sn(s、灰) 下列说法正确的是【 】 (07年高考广东化学卷) A.DH1>DH2 B.锡在常温下以灰锡状态存在 C.灰锡转化为白锡的反应是放热反应 D.锡制器皿长期处于低于13.2 ℃的环境中,会自行毁坏
A.A2、B2、AB均为气体,△H>0 B.A2、AB均为气体,B2为固体或液体,△H>0 C.A2、B2、AB均为气体,△H<0 D.A2、AB均为气体,B2为固体或液体,△H<0 22.右图是某学校实验室从化学试剂商店买回 的硫酸试剂标签上的部分内容。据此下列
A.该试剂的物质的量浓度9.2mol·L-1 B.该硫酸50mL与足量的铜反应,被氧化 的铜的物质的量为0.46mol C.配制250mL 9.2mol·L-1的稀硫酸需取 该硫酸125 mL D.该硫酸与等体积的水混合所得溶液的 质量分数小于49%
 08届高三化学第一学期期中考试 08届高三化学第一学期期中考试
化 学 试 卷
| 题号
| 1
| 2
| 3
| 4
| 5
| 6
| 7
| 8
| 9
| 10
| 答案
|
|
|
|
|
|
|
|
|
|
| 题号
| 11
| 12
| 13
| 14
| 15
| 16
| 17
|
| 答案
|
|
|
|
|
|
|
| 题号
| 18
| 19
| 20
| 21
| 22
|
| 答案
|
|
|
|
| | |||||||||||||||||||||||||||||||||||
第Ⅱ卷(非选择题 共51分)
三、(本题包括3小题,共20分)
23.(4分)某一反应体系有反应物和生成物的粒子共六种:SO ![]() 、I2、、H 、SO
、I2、、H 、SO ![]() 、I-、H2O。已知该反应中I2只发生如下过程:I2→I—,请回答。
、I-、H2O。已知该反应中I2只发生如下过程:I2→I—,请回答。
(1)该反应中的还原剂是 (填分子或离子符号)。
(2)写出该反应的离子方程式
。
(3)若利用该反应原理进行滴定操作,则应选择的指示剂为 (填序号)。
A.淀粉溶液 B.酚酞 C.甲基橙
24.(7分)常温下有浓度均为0.5mol·L-1的四种溶液:①碳酸钠溶液 ②碳酸氢钠溶液 ③盐酸 ④氨水。请根据题目要求回答下列问题:
(1)上述溶液中,可发生水解反应的是 (填序号,下同),在发生水解反应的溶液中pH最大的是 。
(2)上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的是 。
(3)取适量溶液④,加入少量氯化铵固体,此时溶液中 ![]() 的值
的值
(填“增大”或“减小”或“不变”)
(4)将等体积的③和④的溶液混合后,所得溶液中离子浓度由大到小的顺序是
。
(5)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的c(H )= 。
25.(9分)A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物;B与Z的最外层电子数之比2:3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红。请回答下列问题。
(1)Z的原子结构示意图为 ;化合物BA4的电子式为 。
(2)化合物Y2X2中含有的化学键类型有 (填序号)。
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3)化合物A2X和A2Z中,沸点较高的是 (填化学式),其主要原因是
。
(4)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为
。
(5)常温常压下,由A、B、X可组成的液态物质甲。现有2.3g甲与足量的X的单质充分反应,生成标准状况下2.24L的BX2气体和2.7g的A2X液体,同时放出68.35kJ的热量,该反应的热化学方程式为
。
四、(本题包括1小题,共7分)
|
请回答下列问题:
(1)通电一段时间后,可观察到 电极
(填“阴极”或“阳极”)四周溶液颜色先变红,
该电极上的电极反应式为 。
(2)该溶液电解反应的离子方程式为
。
(3)若开始时改用铁棒做阳极,阳极的电极反应式
|
(4)若用H2和O2为反应物,以KOH为电解质溶液,
可构成新型燃料电池(如图),两个电极均由多
孔性炭制成,通入气体由孔隙中逸出,并在电极
表面放电。其中a是 极(填“正”或“负”)。
b极的电极反应式为 。
|
24.(3分)中和热的测定实验(如图)。
①量取反应物时,取50mL0.50mol·L-1的盐酸,
还应加入的试剂是 (填序号)。
A.50mL0.50mol·L-1NaOH溶液
B.50mL0.55mol·L-1NaOH溶液
C.1.0gNaOH固体
②在实验过程中,该同学需要测定并记录的实验数据有 (填序号)。
A.盐酸的浓度 B.盐酸的温度
C.氢氧化钠溶液的浓度 D.氢氧化钠溶液的温度
E.水的比热容 F.反应后混合溶液的终止温度
③若用50mL0.5mol·L-1醋酸溶液代替上述盐酸测定中和热,所得数据 。(填“偏大”或“偏小”或“不变”)
25.(11分)某校化学实验爱好小组为了证实在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,设计了如下图所示的实验装置,按要求回答问题:
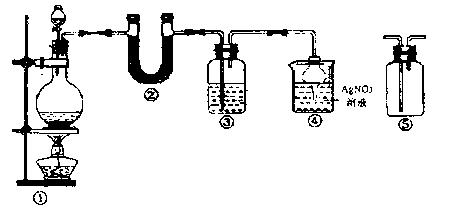
(1)请写出实验室制Cl2所发生反应的化学方程式 。
(2)装置②的作用是 ;
(3)装置③中所盛试剂可能是(只填一种) 。
(4)甲同学认为该实验有缺陷,不能证实最终与AgNO3溶液反应的气体只有一种,提出在某两个装置之间再加装置⑤。你认为装置⑤在 之间(填装置序号),瓶中可以放入 来判定是否只有一种气体与AgNO3溶液反应。
(5)乙同学认为只要将装置④中的AgNO3溶液换成石蕊溶液就可以判定进入④中的气体是否有Cl2,试说明他的判定根据 。
六、(本题包括1小题,共10分)
29.(10分)以天然气为原料合成尿素的生产中的主要反应之一为:
![]() CH4(g) H2O(g) CO(g) 3H2(g);△H>0
CH4(g) H2O(g) CO(g) 3H2(g);△H>0
请根据题目要求回答下列问题:
(1)在一定条件下,将0.05molCH4和0.10molH2O气放入容积2L的密闭容器中,20s时有0.01molCO生成,则H2的化学反应速率为 。
(2)在其它条件不变的情况下降低温度,则逆反应速率 (填“增大”或“减小”或“不变”,下同);在其它条件不变的情况下加压,则正反应速率 。
(3)在一定条件下,当该反应处于化学平衡状态时,下列操作可使化学平衡向正反应方向移动的是 (填序号)。
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.移出水蒸气
(4)在一定温度下,将1.0molCH4和2.0molH2O(g)通入某一恒压容器中,达到化学平衡时,混合气体共4.0mol,则CH4的转化率为 ;若其它条件不变,起始时加入amolCH4 、bmolH2O(g)、c mol CO和d molH2达到平衡时,各组分体积分数与上述平衡完全相等,则a、b和c满足的关系为 (用字母表示)。
08届高三化学第一学期期中考试
化学试卷参考答案
题号
1
2
3
4
5
6
7
8
9
10
答案
B
C
D
A
B
D
C
C
A
C
题号
11
12
13
14
15
16
17
答案
D
B
C
A
B
B
A
题号
18
19
20
21
22
答案
D
D
D
B
C
23.(共4分,未标分数的空,每空1分)
(1)SO ![]() (2)SO
(2)SO ![]() I2 H2O=SO
I2 H2O=SO ![]() 2I- 2H (2分) (3)A
2I- 2H (2分) (3)A
26.(共7分,未标分数的空,每空1分)
(1)①② ①
(2)②
(3)减小
(4)c(C1-)>c(NH4 )>c(H )>c(OH-)(2分)
(5)10-12mol·L-1
|
(1)
(2)A、C
(3)H2O 水分子间存在氢键
(4)4H2O2 H2S=H2SO4 4H2O或H2O2 H2S=S↓ 2H2O(写成H2SO3不得分)(2分)
(5)C2H6O(1) 3O2(g)=2CO2(g) 3H2O(1);△H=-1367kJ·mol-1 (2分)
26.(共7分,未标分数的空,每空1分)
(1)阴极 2H 2e- = H2↑
(2)2C1- 2H2O ![]() C12↑ H2↑ 2OH-(2分)
C12↑ H2↑ 2OH-(2分)
(3)Fe -2e = Fe2
(4)负 O2 2H2O 4e-=4OH-
27.(共3分,每空1分)
① B ②B、D、F ③偏小
28.(共11分)
(1)MnO2 4HCl(浓) ![]() MnCl2 Cl2↑ 2H2 O(2分)
MnCl2 Cl2↑ 2H2 O(2分)
(2)检验水蒸气的存在(2分)
(3)四氯化碳(1分,若苯等其他合理答案参照给分)。
(4)③④ (2分) 湿润的淀粉碘化钾试纸(2分)
(5)Cl2与水反应后的产物能使石蕊褪色(2分)
29.(共10分)
(1) ![]() (2分)
(2分)
(2)减小 增大(每空1分,共2分)
(3)A、D(2分)
(4)50%(2分) 2a c=b(2分)
| |