|
高三化学氮族元素总复习单元测试
一、选择题(每个小题有1个符合题意的答案。每做对一小题可得5分)
1.向铁与铜的混合物中加入一定量的稀硝酸,充分反应后剩余m1g金属,再向其中加入一定量的稀硫酸,充分振荡后剩余m2g金属。则m1与m2之间的大小关系为
(A)m1>m2 (B) m1=m2 (C) m1可能等于m2 (D)m1可能小于m2
2.等物质的量的下列化合物在相应条件下完全分解后得到氧气最多的是
(A) KMnO4(加热) (B) KClO3(加MnO2催化剂,加热)
(C)H2O2(水溶液,加MnO2催化剂) (D)HgO(加热)
3.将空气中氮气转化为氮的化合物的过程称为固氮。下面能实现人工固氮的是
(A)闪电 (B)电解饱和食盐水车间 (C)根瘤 (D)合成氨车间
4.三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
C3N3(OH)3  3HNCO; 8HNCO+6NO2 3HNCO; 8HNCO+6NO2  7N2+8CO2+4H2O 7N2+8CO2+4H2O
下列说法正确的是
(A)C3N3(OH)3与HNCO为同一物质 (B)HNCO是一种很强的氧化剂
(C)1 mol NO2在反应中转移的电子为4 mol (D)反应中NO2是还原剂
5.某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50 mL b mol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是
(A)若金属有剩余,在溶液中再滴入硫酸后,金属不会溶解
(B)若金属全部溶解,则溶液中一定含有Fe3+
(C)若金属全部溶解,且产生336 mL气体(标准状况),则b = 0.3
(D)当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3)
6.足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
(A)60 mL (B)45 mL (C)30 mL (D)15 mL
7. (12分)图中各物质均由常见元素(原子序数≤20)组成。已知A、B、K为单质,且在常温下A和K为气体,B为固体。D为常见的无色液体。I是一种常用的化肥,在其水溶液中滴加AgNO3溶液有不溶于稀HNO3的白色沉淀产生。J是一种实验室常用的干燥剂。它们的相互转化关系如图所示(图中反应条件未列出)。请回答下列问题:
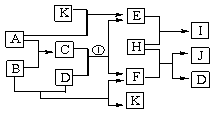
(1)I的化学式为_____________;J的电子式为__________________。
(2)反应①的化学方程式为______________________________________________。
(3)F的水溶液与氯气反应的离子方程式为__________________________________________。
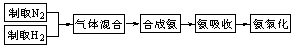
8.(23分)实验室模拟合成氨和氨催化氧化的流程如下:
SHAPE \* MERGEFORMAT
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从图中选择制取气体的合适装置:氮气 、氢气 。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有 、________________。
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨, (“会”或“不会”)发生倒吸,原因是:________________________________________。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是: ,锥形瓶中还可观察到的现象是: 。
(5)写出乙装置中氨氧化的化学方程式:____________________________________________。
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、 、 离子。
9. (16分)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。
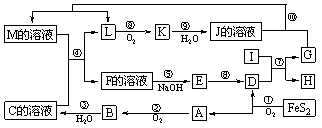
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第______周期第______族。
(2)在反应 = 7 \* GB3 ⑦中氧化剂与还原剂的物质的量之比为________。
(3)在反应 = 2 \* GB3 ②、 = 3 \* GB3 ③、 = 6 \* GB3 ⑥、 = 9 \* GB3 ⑨中,既属于化合反应又能属于非氧化还原反应的是______(填序号)。
(4)反应 = 4 \* GB3 ④的离子方程式是:_________________________________________。
(5)将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是:______________________________。
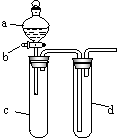 10. (19分)某爱好小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。 10. (19分)某爱好小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是________________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸,c中反应的化学方程式是 __________________________________。再由a向c中加2 mL蒸馏水,c中的实验现象是_________________________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是_______,理由是____________________________。
|
方案 |
反应物 |
|
甲 |
Cu、浓HNO3 |
|
乙 |
Cu、稀HNO3 |
|
丙 |
Cu、O2、稀HNO3 |
(4)该小组还用上述装置进行实验证实氧化性KMnO4>Cl2>Br2,操作步骤为_____________________________________,实验现象为____________________________________________;但此实验的不足之处是___________________________。
参考答案
7.[答案](1)NH4Cl; (3分)  。 (3分) 。 (3分)
(2)Ca3N2+6H2O = 3Ca(OH)2+2NH3↑。(3分)
(3)2OH-+Cl2 = Cl-+ClO-+H2O。 (3分)
9.[答案](1)四(或4);(2分) Ⅷ。(2分) (2)1:2。(3分) (3) = 3 \* GB3 ③。 (3分)
(4)3Fe2++NO3- +4H+ = 3Fe3++NO↑+2H2O。 (3分)
(5)Fe2O3+3KNO3+4KOH  2K2FeO4+3KNO2+2H2O。 (3分) 2K2FeO4+3KNO2+2H2O。 (3分)
10.[答案](1)检查装置气密性;(2分)
(2)Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O; (3分)
反应变缓,气体颜色变淡;(2分)
(3)丙; (2分) 耗酸量最少,无污染。 (2分)
(4)向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸;(3分)
c中有黄绿色气体产生,d中溶液变为黄棕色; (3分)
没有处理尾气。 (2分)
|